《自然·癌症》:PD-1抑制剂治疗中T细胞的变化
来源:奇点糕 2022-01-22 18:16
免疫检查点阻断疗法(ICB)已经在非小细胞肺癌(NSCLC)的临床治疗中取得了前所未有的效果。然而从数据上看,对免疫治疗产生显着应答的NSCLS患者仍然只是少数。这说明尽管免疫治疗的原理我们都懂,但是对于其背后的复杂分子机制,以及同类型癌症患者的肿瘤免疫浸润细胞组分异质性,我们还不够了解。近日,由北京大学的张泽民教授以及中国人民解放军总医院的韩为东和胡毅两位
免疫检查点阻断疗法(ICB)已经在非小细胞肺癌(NSCLC)的临床治疗中取得了前所未有的效果。然而从数据上看,对免疫治疗产生显着应答的NSCLS患者仍然只是少数。
这说明尽管免疫治疗的原理我们都懂,但是对于其背后的复杂分子机制,以及同类型癌症患者的肿瘤免疫浸润细胞组分异质性,我们还不够了解。
近日,由北京大学的张泽民教授以及中国人民解放军总医院的韩为东和胡毅两位科学家领衔的研究团队,在nature cancer发表重要研究成果。
他们对来自36例接受过PD-1抑制剂治疗的NSCLC患者的47个肿瘤样本,进行了瞬时单细胞RNA-seq和TCR-seq,发现对免疫治疗产生应答的患者肿瘤中,耗竭T细胞前体(Texp)出现扩张,而无应答的患者则没有出现这样的现象。
同时,他们认为Texp的扩张最有可能是自我复制以及外周血T细胞分化导致的,而不是终末Tex重新激活。这表明Texp的扩张是改善基于PD-1抑制剂治疗效果的重要步骤。
免疫检查点阻断能破坏T细胞的共抑制信号通路,激活T细胞的抗肿瘤或者是抗感染功能。但随着时间推移,CD8+T细胞长期暴露于相关抗原后便会进入一种特异化的分化状态——耗竭型T细胞(Tex),其中终末Tex是一种抑制性受体高表达,且对特异性抗原几乎没有反应的功能异常细胞。
之前有研究认为,PD-1通路的阻断能将处于慢性感染中的终末Tex逆转为有功能的T细胞,然而后续有研究指出终末Tex的表观遗传学状态很难被改变,意味着ICB几乎不能逆转终末Tex的状态[6]。
但许多的临床研究发现,患者对免疫治疗的应答程度与耗竭T细胞前体(Texp)有关,这是一类抑制性受体低表达的细胞。因此有研究认为,既然Texp不太可能是终末Tex逆转而来,那么其主要来源就是外周血中新近浸润的T细胞。
但是Texp如何对PD-1抑制剂产生反应仍然没有得到解释,以往关于肺癌的研究受限于bulk-seq技术,没有很好的探究免疫检查点阻断产生的免疫反应的细胞基础,而一些利用了单细胞技术的研究则专注于探究未经治疗的肿瘤样本。
基于这样的背景,张泽民教授团队对来自36例NSCLC患者的47个肿瘤样本(其中33个未经治疗,9个治疗后有应答,5个治疗后无应答)进行了单细胞RNA-seq和TCR-seq。经过质控,数据一共包含135391个T细胞,其中56.6%有匹配的TCRα和β链。
在CD4+T细胞中,治疗前后的NSCLC样本在多种T细胞亚型的比例上存在差异。与治疗后有应答的样本相比,治疗前以及治疗后无应答的样本中的Treg都显着上调4-1BB+Treg的特征基因,包括许多与免疫抑制功能有关的基因(IL1R2、REL、LAYN),这与之前的研究一致——在LUAD中4-1BB+Treg与较差的预后有关[8]。
与Treg相反的是,表达CXCL13的Th1样细胞在有应答肿瘤中的比例显着增加,并且有应答肿瘤中Th1样细胞的克隆亚群数量也显着增加,表明这类细胞在免疫治疗应答中有着重要的作用。研究人员在一个已发表的基底细胞瘤也验证了这一结论。
接下来研究人员分析了肿瘤中的CD8+T细胞。他们首先利用细胞染色技术验证了单细胞测序得到的浸润性CD8+T细胞比例的可靠性,发现单细胞测序的结果能够反映真实的肿瘤浸润T细胞水平。同时,与之前的研究一致的是,有应答肿瘤有着比无应答肿瘤更大比例的CD8+T细胞,说明它可以作为预后标志物。
为了更深入的理解CD8+T细胞对基于PD-1抑制剂免疫治疗所产生的反应,研究人员将CD8+T细胞分成了三类,分别是终末Tex、非耗竭T细胞以及增殖性T细胞。在有应答的肿瘤治疗前后的比较中,他们发现如果终末Tex的基线水平较低,那么治疗后Tex的比例会增加,而如果终末Tex的基线水平较高,那么治疗后Tex的比例会减少。
由于终末Tex代表着肿瘤反应性T细胞水平(肿瘤特异性T细胞),因此上述现象表明对免疫治疗有应答的NSCLC患者在治疗后肿瘤的免疫浸润水平会提升,同时其他的T细胞组分也在抗肿瘤过程中发挥了重要作用。
有多个关于小鼠的研究表明PD-1抑制剂治疗不仅能靶向终末Tex,同时还对Texp起作用,能增强其抗肿瘤能力,因此张泽民团队随后利用Texp探究了上述终末Tex比例变化的原因。
他们选取了CD8+T细胞中的终末Tex以及与终末Tex有共同TCR的非耗竭T细胞,并且在聚类中得到了两类新的非耗竭T细胞——GZMK+NR4A2-以及GZMK+NR4A2+T细胞。这两类T细胞均表现出低表达抑制性受体以及高表达GZMK的特征。
之后他们利用已报道的分别与干细胞样、短时、终末Tex有关的特征基因,分析了两种新识别的非耗竭T细胞与终末Tex和中间态Tex的演化关系,发现GZMK+NR4A2+T细胞与终末Tex在演化路径上更相近,他们认为演化方向应该是从GZMK+NR4A2-T细胞到GZMK+NR4A2+T细胞再到终末Tex,并且终末Tex表达的特征基因和老鼠终末分化的Tex特征基因几乎一致,这表明终末Tex的状态是很稳定的,几乎不可逆转。
研究人员由此将GZMK+NR4A2-命名为Texp1,GZMK+NR4A2+命名为Texp2。然后他们将终末Tex和Texp表达的基因与其余CD8+T细胞进行了比较,发现CXCL13几乎只在终末Tex和Texp中表达。
CXCL13是由Tex表达且具有募集免疫细胞至肿瘤功能的基因,但之前的关于无治疗史肿瘤的研究发现CXCL13只在终末Tex中表达。于是研究人员比较他们的数据中治疗前后Texp中CXCL13的表达水平,发现CXCL13只在治疗后有应答肿瘤的Texp中高表达。
接着研究人员分析了多个外部数据,发现CXCL13的表达水平只会随着T细胞耗竭状态的加剧而升高,因此他们认为治疗后表达CXCL13的Texp是阻断了T细胞向终末Tex转变而形成的,但是其CXCL13的表达水平没有受到这种阻断的影响。
为了验证他们的猜想,研究人员探究了治疗前后肿瘤的Texp的丰度变化。
他们分析了13个治疗后NSCLC样本(其中一个有应答的样本因为Tex数量<30最终没有纳入分析),并进行了治疗前后以及有无应答之间Texp比例的比较。
最终研究人员发现,在有应答肿瘤中治疗前的Tex大部分是终末Tex,而治疗后Texp的比例大幅增加,同时治疗后的Tex克隆都表现出耗竭特征基因低表达的特征。而在无应答肿瘤中,治疗后的Texp比例并没有增加,并且与有应答肿瘤相比,无应答肿瘤中治疗后的Tex几乎都高表达耗竭特征基因
研究人员还分析了有应答肿瘤中与Tex无关的T细胞克隆亚群在治疗前后的比例变化,发现这些T细胞克隆亚群并没有出现显着扩张,并且扩张趋势并不一致,说明Tex是对PD-1抑制剂治疗产生反应的主要细胞类型。
那么问题来了,既然Texp不是NSCLC治疗后所独有的,那它是从哪里来的呢?
前面的Texp到终末Tex的演化路径分析已经表明,Texp不太可能是由终末Tex逆转而来,并且也有研究表明终末Tex的表观遗传学状态非常稳定,很难被重新激活。
于是研究人员推测NSCLC治疗后的Texp一种可能来源是已存在的Texp。他们分析了有应答肿瘤治疗前后的Tex亚群是否有交集,发现治疗后有很大比例的Tex亚群都在治疗前存在,并且这些扩张的亚群规模较大。
他们还推测治疗后Texp另一种可能的来源是外周血中的T细胞。
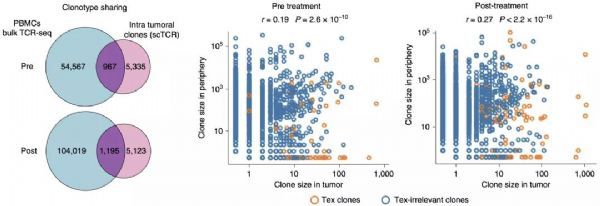
于是研究人员对四个有应答肿瘤对应的治疗前后血液样本做了bulk TCR-seq,经过比较发现在肿瘤组织中出现扩张的T细胞亚群同样能在血液中被检测到,并且血液中与肿瘤中有类似TCR的T细胞的亚群规模是高度相关的。除此之外,他们还发现治疗后肿瘤中新出现的Tex亚群只出现在治疗后的血液中。
不过,上述的现象还不能说明治疗后肿瘤中新出现的Tex亚群是从外周血中进入肿瘤的,研究人员接着在治疗后血液和有应答肿瘤样本中进行了单细胞TCR-seq,进而比较了各个不同采样时间点上血液中Texp和肿瘤中Texp的区别。他们发现肿瘤中的Texp高表达CXCL13,而血液中的T细胞则几乎不表达CXCL3。这表明治疗后有应答的肿瘤中一部分扩张的Texp是来自于外周血的T细胞。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->