Nature Immunology: 转录因子家族对静息和活化T细胞表观基因组的分级调控
来源:本站原创 2022-01-22 18:46
T细胞激活是适应性免疫反应中的一个关键早期事件,受到精细的转录调控
T细胞激活是适应性免疫反应中的一个关键早期事件,受到精细的转录调控。在这项研究中,作者研究了8个主要转录因子(TF)家族的活性是如何整合在一起形成原始的和活化的CD4和CD8T细胞的表观基因组的。通过利用进化分化的小鼠中广泛的多态性,作者确定了对染色质可及性有积极影响的“重量级提升者”。
图片来源: https://doi.org/10.1038/
s41590-021-01086-x
T细胞激活诱导转录和表观遗传变化,这些变化是获得特殊效应器功能的基础。在这项研究中,作者利用实验室和野生近交系小鼠之间的自然遗传变异来鉴定TF,它们的DNA结合基序决定了急性LCMV感染期间幼稚和激活的T细胞染色质的可及性和基因表达。大多数TF结合基序对染色质的可及性有积极的影响,只有少数特异的抑制基序被鉴定出来,包括核受体和特定的锌指基序。
具有无作用或仅有有限作用的TF家族包括E2F、Forkhead、GATA、STAT和Smad。属于这些家族的一些TF可能执行相对特殊的功能,只影响它们与之结合的位点的较小子集,或者在急性刺激后不久起作用。
考虑到T细胞中表达的许多TF,作者的研究出人意料地发现只有几个结合基序对染色质可及性影响最大的“重量级提升器”。 Ets1、RUNX1和TCF1是这三个家族中具有代表性的三个TF,它们总共占据了幼稚T细胞染色质区域的94%左右。Ets1结合定义了丰富在家务基因启动子上的峰,可及性在T细胞激活时基本保持不变。有趣的是,大多数激活诱导的TF的结合位点与Ets1结合的峰重叠,这表明这些因素只在它们所占据的区域中的一小部分影响染色质的可及性。
除了组成性结合位点外,T细胞激活后,部分元件重新获得Ets1结合,并优先与免疫反应基因相关。虽然Ets1新招募的确切机制尚不清楚,但我们推测,除了存在较弱的Ets基序外,Ets1结合的障碍可能包括与抑制性组蛋白修饰和DNA甲基化相关的紧密堆积的染色质。根据这个模型,有报道说foxp3基因内含子调控元件的甲基化可以阻止ets1在其共有基序上的结合和活性。
T细胞表达多个ETS家族TF,在其发育或激活过程中发挥非冗余作用。尽管所有家族成员都有一个高度保守的ETS结构域,并识别一个一致的基序,但它们在体内的结合位点可能是共享的,也可能是成员特异性的。对人类T细胞系中三个ETS家族转录因子结合位点的比较表明,在看家基因的转录起始点,多因子的冗余结合是常见且丰富的,而非冗余结合是罕见的,并在细胞类型特异性增强子上富集。
基于这些观察,作者推测,研究中发现的大多数组成性结合的Ets1靶点都被多个ETS家族TF共同占据,而Ets1up位点可能是由Ets1特异性结合的。重要的是,Ets基序的遗传变异也影响了Ets1未占据的染色质可及性和TF结合位点,这表明其他家族成员可能会与这些元素结合。综上所述,作者的结果表明ETS家族转录因子在T细胞转录组和表观基因组的形成中起着独特的主导作用。
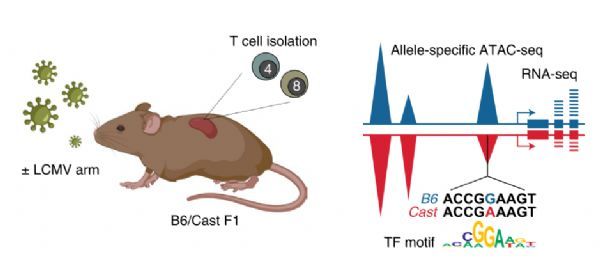
TF结合基序多态性对幼稚和活化T细胞等位基因特异性染色质可及性的影响
图片来源: https://doi.org/10.1038/
s41590-021-01086-x
在本研究中作者的发现提供了一个新的视角来研究定义T细胞特性的关键TF的活动之间的相互作用,并提高我们对静止和激活的CD4和CD8T细胞的转录和表观遗传调节的理解。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。