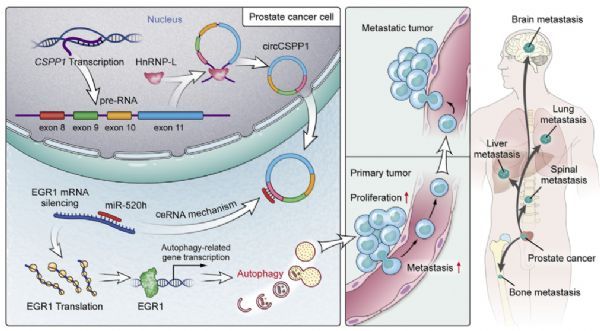
HnRNP-L调控的CircCSPP1/miR-520h/Egr1轴调控前列腺癌自噬和促进进展
来源:本站原创 2022-01-18 14:34
前列腺癌仍然是美国男性癌症死亡的第二大原因,仅次于肺癌。在许多国家,前列腺癌(PCA)的发病率和死亡率都在稳步上升。
前列腺癌仍然是美国男性癌症死亡的第二大原因,仅次于肺癌。在许多国家,前列腺癌(PCA)的发病率和死亡率都在稳步上升。前列腺癌的形成和发展有许多分子机制,包括DNA体细胞突变、有害基因融合、不规则甲基化和RNA异常剪接。CircRNAs是由RNA结合蛋白(RbPs)催化的一类新的非编码RNA,已被报道与多种癌症的进展有关。
图片来源: https://doi.org/10.1016/j.omtn.2021.10.006
环状rna越来越受到非编码rna研究领域的关注。circRNAs的异常调节在多种癌症中都有报道,包括黑色素瘤、膀胱癌、肝细胞癌和神经胶质瘤。尽管最近有报道称CircCSPP1与卵巢癌和结直肠癌的肿瘤增殖、侵袭和转移有关,但其环状结构尚未在这些研究中得到证实。
越来越多的证据表明,包括lncRNAs和miRNAs在内的非编码RNA参与了自噬相关的肿瘤进展;然而,CircRNAs很少被报道与自噬或癌症进展有关,特别是在前列腺癌中。以往的研究表明,CircRNAs在多种细胞功能中发挥着重要作用,包括竞争内源RNA(CerNA)、翻译多肽、调节转录、作为蛋白质复合物的支架等。
本研究的重点是破译前列腺癌CircCSPP1、自噬和肿瘤进展之间的机制关系。根据我们的数据,CircCSPP1主要定位于细胞质中,AGO2 RIP显示CircCSPP1与AGO2特异性结合,表明CircCSPP1起到miRNA海绵的作用。通过生物信息学分析寻找与CircCSPP1结合的候选miRNAs,确定miR-520h为CircCSPP1的下游靶点。
基于公开可用的数据集和作者自己的患者样本的分析表明,miR-520h不仅抑制了前列腺癌的自噬,而且还抑制了肿瘤的增殖、迁移和侵袭。FISH和双荧光素酶分析表明miR-520h是CircCSPP1的直接靶点。对多个相关数据集的生物信息学分析表明,EGR1是唯一重叠的基因。
通过qPCR、FISH和双荧光素酶报告基因分析,作者进一步证实EGR1是miR-520h的直接靶点。用miR-520h模拟物进行的抢救实验表明,EGR1可通过诱导自噬促进细胞活力、迁移和侵袭,这种作用可能被miR520h部分抵消。
最后,作者验证了CSPP1/miR-520h/Egr1轴在前列腺癌样本和癌性异种移植瘤中的相关性。据报道,EGR1通过转录影响自噬相关基因的表达来调节自噬,包括LC3B。有必要进行进一步的研究,以确定前列腺癌中受EGR1调控的其他重要的自噬相关基因。
一个示意性模型表明,hnRNP-L上调了CircCSPP1的表达,CircCSPP1/miR-520h/Egr1轴通过自噬促进了前列腺癌的进展
图片来源: https://doi.org/10.1016/j.omtn.2021.10.006
综上所述,作者的研究阐明了hnRNP-L、circCSPP1、miR-520h和EGR1在前列腺癌中的关联及其促进恶性肿瘤的潜在潜在机制。HnRNP-L过表达上调CSPP1/miR520h/EGR1轴,诱导自噬,最终加速前列腺癌进展。最重要的是,作者的研究为CircRNAs在调节前列腺癌自噬中的作用提供了新的见解。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。