阿尔兹海默病研究全新成果一览!
来源:本站原创 2021-11-27 10:38
阿尔兹海默病(AD)是一种神经变性病,主要以进行性记忆力减退和获得性知识丧失,直至日常生活活动能力完全丧失为特征。有数据显示,我国阿尔兹海默病患者已经超过了1000万,居全球之首,预计到2050年这一数字将突破4000万。近年来,科学家们投入了大量精力对这种疾病的机理以及新型疗法进行研究,本文中,小编就整理了近期他们在阿尔兹海默病研究领域取得的重要研究成果,
阿尔兹海默病(AD)是一种神经变性病,主要以进行性记忆力减退和获得性知识丧失,直至日常生活活动能力完全丧失为特征。有数据显示,我国阿尔兹海默病患者已经超过了1000万,居全球之首,预计到2050年这一数字将突破4000万。
近年来,科学家们投入了大量精力对这种疾病的机理以及新型疗法进行研究,本文中,小编就整理了近期他们在阿尔兹海默病研究领域取得的重要研究成果,分享给大家!
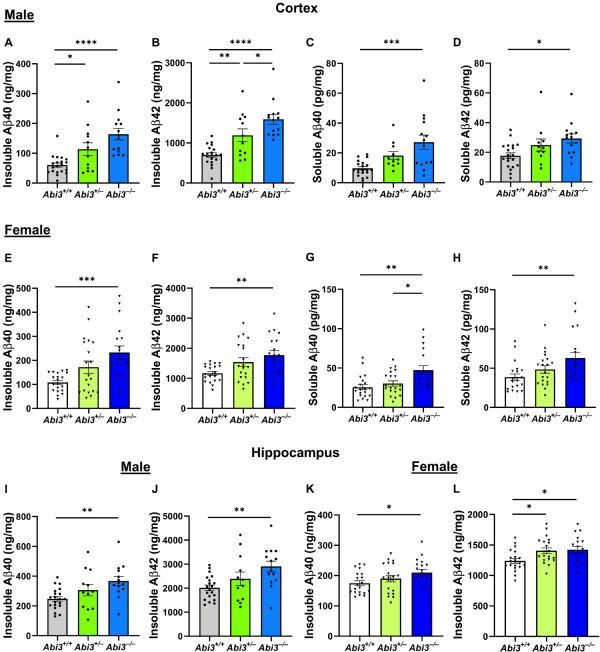
雄性和雌性Abi3−/−小鼠机体大脑皮层和海马体中Aβ的积累水平会增加。
图片来源:HANDE KARAHAN,et al. Science Advances (2021). DOI:10.1126/sciadv.abe3954
【1】Sci Adv:剔除ABI3基因或会增加个体患阿尔兹海默病的风险
doi:10.1126/sciadv.abe3954
当机体免疫细胞在整个大脑中移动时,其能作为第一道防线来抵御病毒、毒性物质和受损的神经元,并将其从体内清除。近日,一篇发表在国际杂志Science Advances上题为“Deletion of Abi3 gene locus exacerbates neuropathological features of Alzheimer's disease in a mouse model of Aβ amyloidosis”的研究报告中,来自印第安纳大学医学院等机构的科学家们通过研究揭示了大脑中名为小胶质细胞的免疫细胞如何与最近在阿尔兹海默病患者体内发现的基因突变相关联的,文章中,研究者发现,剔除名为ABI3的基因或能明显增加大脑中β淀粉样斑块的积累,并减少斑块周围小胶质细胞的水平。
研究者Karahan表示,本文研究或能帮助科学家们进一步理解促进疾病发生的小胶质细胞的关键功能,同时还能帮助识别新型治疗靶点;本文中研究人员对超过8.5万名携带ABI3基因突变的个体(其中不到一半的个体为阿尔兹海默病患者)进行了一项人类遗传学研究,这种突变会增加个体患晚期阿尔兹海默病的风险。目前研究人员并没有在大脑中调查ABI3基因的功能或者该基因如何影响小胶质细胞的功能,这项研究中,研究人员从阿尔兹海默病小鼠模型中剔除了ABI3基因,并在细胞培养物中检测了该基因在小胶质细胞中的功能;在小鼠模型中,他们观察到大脑中斑块和炎症水平的增加以及突触功能异常的迹象,这些特征与该疾病患者的学习和记忆功能缺陷相关。
此外,研究者表示,该基因的剔除会损伤小胶质细胞的移动,免疫细胞无法靠近斑块从而来尝试清除蛋白,淀粉样斑块通常存在于阿尔兹海默病患者的大脑中,而β淀粉样蛋白则会聚集并形成斑块,从而就能破坏神经细胞的连接。研究者指出,本文研究提供了首次功能性证据表明,ABI3基因功能的缺失或会通过影响β淀粉样蛋白的积累和神经炎症的发生从而就会增加个体患阿尔兹海默病的风险。在过去几十年里,研究者Karahan一直从事阿尔兹海默病的研究,他们获得了多项基金用于开展相关的研究;其中有一项基金就是帮助研究人员开发新型小鼠模型,从而就能使得他们实现在机体中的任何细胞类型中剔除ABI3基因,比如大脑小胶质细胞和外周免疫细胞等;一旦研究者证实了这种新型模型,他们就会将这种模型分享给其他研究人员进行其它类型的研究。
【2】eLife:科学家在动物模型中成功消除关键的阿尔兹海默病特征 未来或有望帮助开发新型靶向性疗法
doi:10.7554/eLife.72034
载脂蛋白E4(ApoE4)是晚期阿尔兹海默病(AD)发生最重要和普遍的风险因素,ApoE4的等电点能与体内早期的核内体(endosome)的pH相匹配,从而导致其与ApoE4受体的解离发生延迟,这就会损伤溶酶体的运输程序,并破坏突触的平衡并减少淀粉样蛋白的清理速度;近日,一篇发表在国际杂志eLife上题为“NHE6 depletion corrects ApoE4-mediated synaptic impairments and reduces amyloid plaque load”的研究报告中,来自德克萨斯大学西南医学中心等机构的科学家们通过研究发现,改变部分大脑细胞的生化特征或许就能摧毁阿尔兹海默病小鼠模型大脑中β淀粉样斑块的形成,相关研究结果或有望帮助科学家们开发有效防治破坏这种破坏人类记忆疾病的新型疗法。
医学博士Joachim Herz说道,我们设想,作用于在小鼠机体中抑制的相同蛋白的药物或许有朝一日就像他汀类药物在心脏病治疗中所发挥的作用,在阿尔兹海默病中也会扮演类似的角色。从而就能帮助有效预防疾病的进展。目前近600万美国人都患有阿尔兹海默病,其中绝大部分患者在65岁以后会发展为晚发性的疾病。阿尔兹海默病的主要特征是大脑细胞会被一种称之为β淀粉样蛋白构成的细胞外斑块和一种称之为tau的蛋白所堆积;尽管这种疾病目前病因尚不明确,但科学家们很早就知道,晚发性阿尔兹海默病最重要的遗传风险因素就是ApoE4,其是参与哺乳动物机体脂肪代谢的蛋白质的三个突变体之一。在人类机体中,与拥有最常见的ApoE3突变体相比,携带ApoE4的突变体或会让个体患阿尔兹海默病的平均发病年龄下降数年,而更为罕见的ApoE2则似乎会对机体抵御这种疾病有一定的保护作用。
这三个版本的ApoE在结构上非常相似,与ApoE2相比,ApoE3包含着一种氨基酸的替代物,从而就会导致该蛋白质携带更多的正电荷;ApoE4突变体则包含两种氨基酸替代物,这就会导致其所携带的正电荷是三种ApoE蛋白中最高的,这些差异影响晚发性阿尔兹海默病发病背后的机制,目前研究人员并不清楚。
这篇研究报告中,研究人员将目光投向了早期核内体的研究,核内体是用于对蛋白质进行分类的细胞器,其能将蛋白质回收再利用,或者通过细胞内部将其转运到溶酶体中。此前研究结果表明,与携带另外两种ApoE突变体相比,核内体或许在携带ApoE4的人类和动物机体中会扩大。利用遗传修饰小鼠来模拟阿尔兹海默病并产生人类版本的ApoE4和β淀粉样蛋白,研究人员就发现,ApoE4上的正电荷会促进蛋白质在早期核内体中堆积,因为ApoE4的电荷能与核内体中的环境相互匹配,这种堆积会阻止这些细胞器无法继续在细胞中运输、回收或帮助处理其它蛋白质,包括β淀粉样蛋白等。
【3】ADDADM:利用抗氧化剂或能有效预防阿尔兹海默病的发生
doi:10.1002/dad2.12231
脂蛋白E (APOE) ε4和氧化性压力之间的实质性关联可能是阿尔兹海默病风险增加背后的原因。近日,一篇发表在国际杂志Alzheimer's & Dementia:Diagnosis, Assessment & Disease Monitoring上题为“Effect of APOE ε4 allele on levels of apolipoproteins E, J, and D, and redox signature in circulating extracellular vesicles from cognitively impaired with no dementia participants converted to Alzheimer's disease”的研究报告中,来自加拿大的科学家们通过研究发现,血液中的氧化-抗氧化失衡或许是阿尔兹海默病的早期指标,而并不是后果;这或许就为有效预防阿尔兹海默病的发生提出了一种策略,即摄入抗氧化剂。
研究者认为,参与阿尔兹海默病的氧化性标志物在患者疾病发生前的5年就已经开始增加了,这或许就表明,机体的氧化作用或许会成为指示该疾病的早期标志物。目前阿尔兹海默病影响着超过50万加拿大人的健康。由于患者机体的氧化性压力水平会增加,因此研究人员或许可以通过调节其机体的抗氧化系统来干预疾病的发生和进展;比如,研究者可以调节其抗氧化系统的组分,包括脂质蛋白J和D,其在血液中能帮助运输脂质和胆固醇,同时其还在大脑功能和阿尔兹海默病的发生上扮演着关键角色,另外一条途径则是通过机体的营养摄入来增加抗氧化剂的摄入。
与用于诊断阿尔兹海默病的一套侵入性和昂贵的测试技术不同的是,本文中的研究人员所发现的氧化标志物能利用血液测试技术来检测,这些标志物存在于血浆的胞外囊泡中,其是由机体所有细胞所释放的袋状结构,包括大脑中的细胞。文章中,研究人员重点对散发性的阿尔兹海默病进行了研究,其是阿尔兹海默病最常见的形式,主要是因为APOE4易感基因的存在所导致的,目前研究人员已经对该疾病的其它早期标志物进行了相关研究。
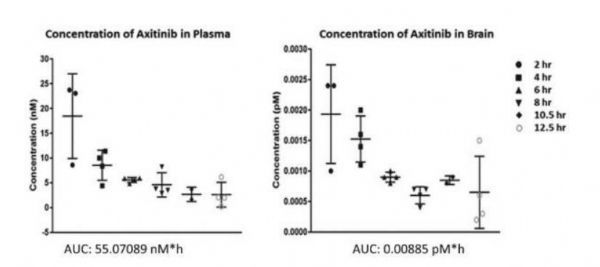
在小鼠血浆和脑组织中对阿西替尼的浓度进行测定。
图片来源:Chaahat S.B. Singh,et al. EBioMedicine (2021). DOI: 10.1016/j.ebiom.2021.103503
【4】EbioMedicine:癌症化疗药物阿西替尼或能有效逆转阿尔兹海默病的病理学表现!
doi:10.1016/j.ebiom.2021.103503
认知能力下降会导致痴呆症发生,并会伴随β淀粉样蛋白(Aβ)在神经斑块中积累以及由高度磷酸化的tau蛋白(tau)中组成的神经纤维缠结(NFT)的出现,这是此前研究人员观察到了阿尔兹海默病(AD)的主要标志,而且研究人员还在阿尔兹海默病患者的大脑样本中发现了血管增多的现象,这与观察结果基本一致。近日,一篇发表在国际杂志EbioMedicine上题为“Reversing pathology in a preclinical model of Alzheimer's disease by hacking cerebrovascular neoangiogenesis with advanced cancer therapeutics”的研究报告中,来自英属哥伦比亚大学等机构的科学家们通过研究发现,一种常用于治疗癌症的药物或能帮助恢复表现为阿尔兹海默病症状的小鼠机体的记忆和认知功能。
研究者表示,名为Axitinib的药物能抑制大脑中新血管的生长,而这是癌症肿瘤和阿尔兹海默病所拥有的共同特征,但这一特征代表了阿尔兹海默病疗法的一个新目标;接受疗法的阿尔兹海默病小鼠不仅会展现出大脑中血管的减少以及其它阿尔兹海默病标志物,而且其在测量学习和记忆的测试中表现地非常优异。研究者Wilf Jefferies教授说道,据估计,阿尔兹海默病在全球影响着5000万人的生命,该病的特点主要是认知功能下降、记忆丧失和大脑功能障碍。
此前,潜在的阿尔兹海默病疗法已经在动物模型中展现出了一定前景,但在临床试验中却屡屡失败。通常情况下,这些策略能靶向作用tau蛋白或β淀粉样蛋白,本文研究中,研究人员选择了一种不同的方法,他们不考虑传统的目标,而是重点研究如何有效遏制血管生成,即心血管的产生。Jefferies教授说道,绝大多数的临床试验都直接或间接地靶向作用β淀粉样蛋白或tau蛋白,除了一些有争议的结果之外,这些临床试验的成功率很低,因此,后期研究人员还需要投入大量的研究来指向逆转阿尔兹海默病的错误靶标。
【5】Sci Adv:科学家开发出一种有望对阿尔兹海默病实现可靠诊断的新型血液检测技术
doi:10.1126/sciadv.abj2137
量化血液中涉及阿尔兹海默病(AD)的蛋白质聚集物的物理性差异或能为提示疾病阶段提供关键的信息;如果一个人怀疑自己身患阿尔兹海默病,那么其就必须为漫长而复杂的治疗性步骤做好准备,直至病情变得明朗;近日,一篇发表在国际杂志Science Advances上题为“Spatial organization of protein aggregates on red blood cells as physical biomarkers of Alzheimer's disease pathology”的研究报告中,来自瑞士联邦材料科学与技术研究所等机构的科学家们通过研究开发了一种新型血液检测技术,其或能利用原子力显微镜(AFM)对疾病进行可靠的诊断。
一开始,物理学家Peter Nirmalraj就想通过研究来理解阿尔兹海默病发生的分子病理学表现,从而开发新型诊断技术和治疗性策略;随后研究者将进一步解析与神经变性疾病相关的β淀粉样蛋白和tau蛋白所扮演的确切性角色,因此,研究者Peter Nirmalraj不仅要检测到可疑蛋白质的存在,而且还要确定其可变的形状、形式以及水平。
目前的方法能帮助研究者确定体液中两种蛋白质的总体水平,然而,这些技术并不允许可视化分析蛋白质聚集物的形状和状况差异;因此,本文研究人员就通过研究开发了这项能在血液中进行纳米级别的观察分析,且不会破坏蛋白质的结构和形态的新型技术。文章中,研究人员联合完成了初步的研究,在其试点研究中,他们分析了来自50名患者和16名健康受试者机体的血液样本,利用AFM技术,研究者在不了解其机体健康状况的情况下,分析了每个人机体大约1000个红细胞的表面,这是确保对数据的解释保持客观性的唯一方法。
【6】Nat Med:大脑组织的炎症或许是阿尔兹海默病进展的关键因素!
doi:10.1038/s41591-021-01456-w
目前有令人信服的研究证据表明,小胶质细胞的激活参与了阿尔兹海默病中tau蛋白缠结在新大脑皮层中的扩散。近日,一篇发表在国际杂志Nature Medicine上题为“Microglial activation and tau propagate jointly across Braak stages”的研究报告中,来自匹兹堡大学医学院等机构的科学家们通过研究发现,神经炎症或许是大脑中病理性错误折叠的蛋白扩散的关键驱动因素,其会导致阿尔兹海默病患者的认知功能障碍发生。
这篇研究中,研究人员有史以来首次在活体患者机体中进行研究,神经炎症,即大脑中常驻的免疫细胞—小胶质细胞的过度激活,其不仅仅是疾病进展的结果,相反,其还是一种关键的上游机制,对于疾病的发展不可或缺。医学博士Tharick Pascoal说道,如今我们注意到许多阿尔兹海默病患者会被忽视,这样其就无法得到适当的护理;而本文研究表明,旨在减少淀粉样斑块形成和限制神经炎症的组合性疗法或许要比单独解决每种病理现象更加有效。
阿尔兹海默病的特点是淀粉样斑块的积累(停留在大脑中神经细胞之间的蛋白质聚集物)和称之为tau缠结的无序蛋白质纤维聚集物在神经细胞内的形成。尽管在培养中的细胞核实验室动物研究中积累了充分的证据来表明,小胶质细胞的激活会驱动阿尔兹海默病tau纤维的扩散,但这一过程目前尚未在人类机体中得到证实。本文研究结果表明,靶向作用神经炎症或许有益于早期阶段的阿尔兹海默病患者,而且还能有助于逆转或至少减缓大脑中病理性tau蛋白的积累并避免痴呆症的发生。
【7】Nature:恢复“伴侣”蛋白的功能或能预防诸如阿尔兹海默病等神经变性疾病患者机体中毒性斑块的积累
doi:10.1038/s41586-021-03824-5
蛋白质质量控制系统对细胞功能和有机体的健康至关重要,目前大多数已知的蛋白质控制系统都是多组分的机器,其能通过ATP调节的与非原生蛋白质之间的相互作用来发挥作用并防止蛋白质聚集和促进其折叠,很少有系统能通过不同的机制来广泛地促进蛋白质的这些,此外,含有广泛带电的poly-Asp/Glu (聚D/E)区域的蛋白质在真核生物的蛋白质组中很常见,但其生化活性研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“DAXX represents a new type of protein-folding enabler”的研究报告中,来自宾夕法尼亚大学Perelman医学院等机构的科学家们通过研究首次揭示了恢复蛋白质DAXX和一大群类似蛋白质的水平如何防止已知的能驱动阿尔兹海默病和其它神经变性疾病的“恶劣”蛋白质的错误折叠以及引发癌症的特定突变,相关研究结果或有望帮助开发新型靶向性策略来恢复旨在保持关键蛋白质控制和预防疾病的生物系统的功能和平衡。
本文研究中,研究人员重点对DAXX蛋白进行了研究,其是一种死亡结构域相关蛋白,也是人类蛋白大家族中的一员,每种蛋白质都具有异常高的两个特定氨基酸残疾,即天冬氨酸和谷氨酸,其被称为聚D/E蛋白,DAXX和大约50种其它的聚D/E蛋白质在细胞过程所扮演的多种角色随着时间推移逐渐会被研究人员阐明,但其在蛋白质质量控制系统中的角色(即指导蛋白质折叠的伴侣分子)却是研究人员意料之外的。
研究者Xiaolu Yang教授说道,我们解决了一个长达数十年的研究难题,表明,这组蛋白实际上构成了细胞中一种主要的蛋白质质量控制系统,同时也是一种从未见过的促进多种蛋白质正确折叠的关键因素,包括与多种疾病相关的易折叠蛋白质。正常情况下,蛋白质质量控制系统能保持蛋白质家族的正常运转,但“恶劣”蛋白质的缠结或许就会降低或完全阻断蛋白质家族正常运转的能力。
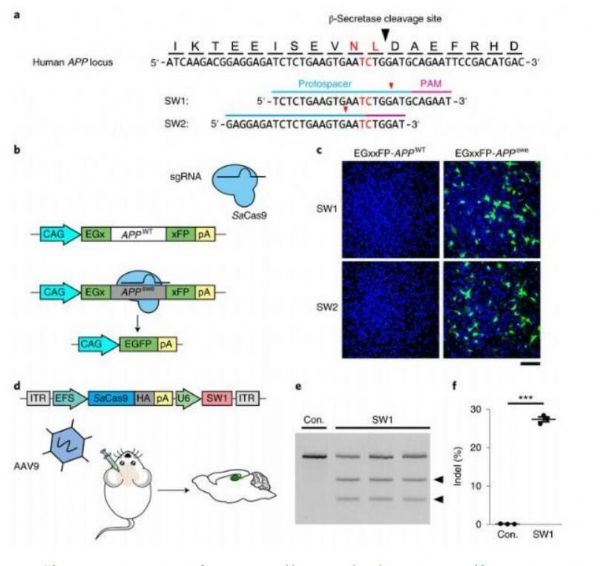
设计和验证CRISPR-Cas9介导的基因组编辑从而破坏突变的APPswe等位基因。
图片来源:Duan, Y.,et al. Nat Biomed Eng (2021). doi:10.1038/s41551-021-00759-0
【8】Nat Biomed Eng:重磅!科学家成功开发出了一种有望治疗阿尔兹海默病的新型全脑基因组编辑技术!
doi:10.1038/s41551-021-00759-0
家族性阿尔兹海默病是由编码淀粉样β前体蛋白(app)的基因以及编码早老蛋白1(presenilin 1)和早老蛋白2(presenilin 2)的基因发生显性突变所引发,其病理学特征是在多个大脑区域中出现细胞外淀粉样斑块和细胞内的神经纤维缠结。近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Brain-wide Cas9-mediated cleavage of a gene causing familial Alzheimer’s disease alleviates amyloid-related pathologies in mice”的研究报告中,来自中国香港科技大学等机构的科学家们通过研究利用全脑基因组编辑技术开发出了一种新技术,其或能减少遗传修饰的阿尔兹海默病小鼠模型机体的阿尔兹海默病病理学表现,这项先进的技术或许还具有巨大的潜力,来转化为一种新型的长效策略来治疗阿尔兹海默病患者。
仅在中国,估计就有超过50万名患者患有遗传性阿尔兹海默病,其是一种家族性的阿尔兹海默病,即一种与家族史高度相关的先天性阿尔兹海默病形式,尽管家族性的阿尔兹海默病有着明确的遗传原因,并且能在患者认知问题发生之前被诊断出来,但目前并没有有效的治疗性手段。使用基因组编辑技术作为治疗因遗传性突变所引起的疾病(比如家族性阿尔兹海默病等)的策略有着巨大的应用前景,其对于疾病症状出现之前纠正致病性基因突变非常有用,对于这种情况,这种策略就被认为是一种一劳永逸的治疗性手段,因为其所产生的效果可以持续一生。然而,目前往往存在多个障碍阻碍了这一技术的临床应用和前景,最主要的就是缺乏有效、高效和非侵入性的手段来将基因编辑制剂运输到机体大脑中;此外,当前的基因组编辑技术也无法在整个大脑中产生有益的治疗结果。
这篇研究报告中,研究人员开发了一种新型的基因组编辑技术,其不仅能够跨越血脑品章,还能将优化的基因组编辑工具运输到整个大脑中,利用这种新设计的基因组编辑运输工具,这种新技术就能通过单一无创的静脉注射从而实现高效的全脑基因组编辑,而且这还能有效地破坏阿尔兹海默病小鼠模型中引起家族性阿尔兹海默病的突变,并能够改善整个大脑中阿尔兹海默病的疾病症状,同时还能为后期开发新型治疗性策略提供思路。
【9】Neurology:机体动脉硬化程度增加或与阿尔兹海默病风险增加直接相关
doi:10.1212/WNL.0000000000012257
此前有研究人员推测,主动脉硬化程度的增加与脑脊液水平增加直接相关,近日,一篇发表在国际杂志Neurology上题为“Association of Aortic Stiffness With Biomarkers of Neuroinflammation, Synaptic Dysfunction, and Neurodegeneration”的研究报告中,来自范德堡大学医学中心等机构的科学家们通过研究发现,机体主动脉的僵硬程度增加或与老年人群阿尔兹海默病病理学程度增加有关,而这反映在了脑脊液中测定的一系列神经化学指标上。
医学博士Elizabeth Moore表示,本文研究结果对于阿尔兹海默病的预防有着重要的意义,基于此前研究结果,本文中我们识别出了特定的病理学通路,通过这种通路我们就能将机体心血管健康与衰老过程中机体的认知功能下降关联起来;研究人员发现了动脉僵硬程度增加与阿尔兹海默病中存在的所有病理学过程直接相关,这些病理学过程包括炎性标志物、突触损伤、神经原纤维缠结和神经变性等。随着研究人员对机体心血管健康影响阿尔兹海默病生物标志物的理解,未来或有望开发出更多潜在的预防性策略和新型阿尔兹海默病疗法。
本文研究发现基于研究人员对60-90岁的146名参与者的研究结果,这些参与者均为患痴呆症和神经性疾病,其来自于范德堡记忆和衰老研究计划中,这一研究计划中,研究人员重点揭示了能加速或改善阿尔兹海默病患者临床表现的损伤途径。尽管引发阿尔兹海默病或许并没有单一的原因,但一系列的神经化学指标被认为不仅能定义阿尔兹海默病的核心病理学表现和疾病的进展情况,而且还能定义无症状患者机体的阿尔兹海默病风险。此前研究中,研究人员发现主动脉的僵硬程度与两种阿尔兹海默病生物标志物直接相关,即β淀粉样蛋白的增加和磷酸化tau蛋白的沉积等。
【10】JACS:揭示新型阿尔兹海默病β淀粉样蛋白的多态特性
doi:10.1021/jacs.1c03346
阿尔兹海默病(AD)是一种会导致痴呆症发生的神经系统疾病,随着患者年龄的增长,其往往会表现出认知、记忆和心里缺陷等,而且病情会不断恶化。虽然目前的治疗方法重点关注在一定程度上缓解患者的疾病症状,但阿尔兹海默病并没有明确的预防或治疗方法,这或许就需要研究人员不断努力来理解该病的生物学特性。
致病性β淀粉样(Aβ)蛋白纤维在大脑中以斑块的形式积累或许是阿尔兹海默病发生的一个标志,因此,解析其结构组织对于设计出靶向性疗法来治疗阿尔兹海默病至关重要;尽管如今研究人员已经报道了Aβ40蛋白的多种不同形式或多态性,但对于更具致病性的Aβ42的理解却很少,此外,利用标准的分析技术从少量样本中识别出微量的Aβ,对于科学家们而言仍然是一大挑战。
近日,一篇发表在国际杂志Journal of the American Chemical Society上题为“Sensitivity-Enhanced Solid-State NMR Detection of Structural Differences and Unique Polymorphs in Pico- to Nanomolar Amounts of Brain-Derived and Synthetic 42-Residue Amyloid-β Fibrils”的研究报告中,来自日本理化研究所等机构的科学家们通过研究分析了固态核磁共振(SSNMR,solid-state nuclear magnetic resonance)光谱技术在解析Aβ及其相关致病性纤维的原子级结构差异上的适用性,这种强大的分析技术能够测定原子核在磁场和电场影响下的不同行为和特性,这或许就能突出其原子结构。
研究者Ishii表示,尽管Aβ42纤维在病理学上非常重要,但在生理相关条件下制备的Aβ42纤维的结构变化的信息非常有限;本文研究中,研究人员阐明了,利用1H(氢同位素)检测的SSNMR技术在分析患者衍生的以及合成性的Aβ纤维方面的应用,因为其数量非常有限,能低至皮摩尔至纳摩尔。在传统上用于结构特征分析的13C(碳同位素)检测的SSNMR技术需要大量样本,并且在制备均匀的样本上存在一定困难。鉴于较高的灵敏性以及容易分析生物样本中的微量成分,研究人员使用了灵敏度增强的1H检测SSNMR技术来进行分析。来自阿尔兹海默病患者机体的合成性纤维和大脑衍生的Aβ能在特定的氨基酸残基上被标记为同位素13C和15N,从而就能增强检测的灵敏性、原子分辨率以及对特定部位进行结构分析。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。