溃疡性结肠炎(UC)新药!欧盟批准百时美施贵宝Zeposia新适应症:治疗UC的口服S1P受体调节剂!
来源:本站原创 2021-11-24 05:09
Zeposia是欧盟获批治疗UC的第一款S1P受体调节剂。
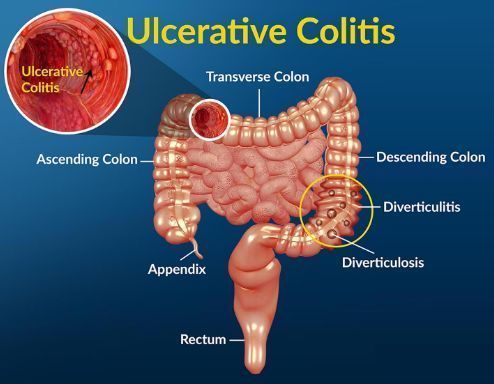
溃疡性结肠炎(UC,图片来源:healthjade.com)
2021年11月24日讯 /生物谷BIOON/ --百时美施贵宝(BMS)近日宣布,欧盟委员会(EC)已批准抗炎药Zeposia(ozanimod)一个新的适应症:用于治疗对常规疗法或生物制剂应答不足、失应答或不耐受的中度至重度活动性溃疡性结肠炎(UC)成人患者。Zeposia是一种口服药物,每天服用一次,该药是一种鞘氨醇-1-磷酸(S1P)受体调节剂,以高亲和力选择性地结合S1P亚型1(S1P1)和5(S1P5)。在美国和欧盟,Zeposia之前已被批准治疗多发性硬化(multiple sclerosis,MS)。
值得一提的是,Zeposia是欧盟第一个也是唯一一个被批准用于治疗溃疡性结肠炎(UC)的口服鞘氨醇-1-磷酸(S1P)受体调节剂,代表了治疗这种慢性免疫介导性疾病的新方法。在美国,Zeposia于2021年5月获得批准,成为美国第一款治疗UC的口服S1P受体调节剂,该药适用于治疗中度至重度活动性UC成人患者。针对该适应症,百时美施贵宝向美国FDA提交了一张优先审查凭证(PRV)来加速审查。
Zeposia治疗UC新适应症的批准,基于关键3期TRUE NORTH研究(NCT02435992)的结果。这是一项安慰剂对照研究,评估了Zeposia作为一种诱导和维持疗法治疗中度至重度UC成人患者的疗效和安全性。结果显示,与安慰剂组相比,Zeposia治疗组在第10周和第52周的全部主要和次要疗效终点(包括临床缓解、临床应答、内镜改善、内镜组织学粘膜改善)均有显著改善。该研究中观察到的总体安全性与Zeposia已批准的标签中的已知安全性一致。
百时美施贵宝免疫学和纤维化开发高级副总裁Jonathan Sadeh医学博士表示:“欧盟委员会批准Zeposia治疗溃疡性结肠炎,使医生和患者现在有了一种每天一次的口服治疗选择。Zeposia已被证明具有良好的疗效和安全性,并具有不同于其他疗法的作用机制。我们期待着为欧洲符合资格的患者带来这款新疗法,显著缓解症状并实现持久临床缓解。”
TRUE NORTH研究(NCT02435992)是一项多中心、随机、双盲、安慰剂对照3期试验,评估了Zeposia作为诱导和维持疗法治疗中度至重度UC成人患者的疗效和安全性。结果显示,该研究达到了2个主要终点:在诱导期第10周和维持期第52周,与安慰剂相比,Zeposia在主要终点和关键次要终点均有高度统计学意义和临床意义的改善。
——在诱导期第10周(Zeposia组n=429 vs 安慰剂组n=216),试验达到了临床缓解的主要终点(18% vs 6%,p<0.0001)以及关键次要终点,包括临床反应(48% vs 26%,p<0.0001)、内镜改善(27% vs 12%)、内镜组织学粘膜改善(13% vs 4%,p<0.001)。
——在维持期第52周(Zeposia组n=230,安慰剂组n=227),试验达到了临床缓解的主要终点(37% vs 19%,p<0.0001)以及关键的次要终点,包括临床反应(60% vs 41%,p<0.0001)、内镜改善(46% vs 26%,p<0.001)、无皮质类固醇临床缓解(32% vs 17%)、内镜组织学粘膜改善(30%vs 14%,p<0.001)。在接受Zeposia治疗的患者中,早在第2周(即完成所需7天剂量滴定后1周)就观察到直肠出血和大便次数分项得分的减少。
根据该研究结果,Zeposia是在3期研究中治疗中度至重度UC方面显示出临床益处的第一个口服S1P受体调节剂。该研究中观察到的总体安全性与Zeposia已批准的标签中的已知安全性一致。
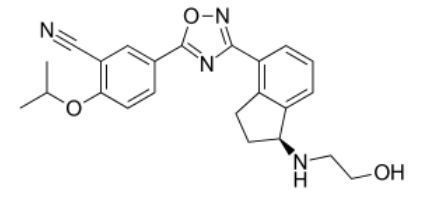
ozanimod分子结构式(图片来源:Wikipedia)
溃疡性结肠炎(UC)是一种慢性炎症性肠病(IBD),其特点是免疫反应异常,持续时间长,在大肠(结肠)粘膜(衬里)产生长期炎症和溃疡(溃疡)。症状包括血便、严重腹泻和频繁的腹痛,通常是随着时间的推移而不是突然出现的。UC对患者的健康相关生活质量有着重要影响,包括身体机能、社会和情感健康以及工作能力。许多患者对目前可用的疗法反应不足或根本没有反应。据估计,全世界有1260万人患有IBD。
Zeposia的活性药物成分ozanimod是一种口服鞘氨醇-1-磷酸(S1P)受体调节剂,以高亲和力选择性地结合S1P亚型1(S1P1)和5(S1P5)。
2020年3月,Zeposia获得美国FDA批准,用于治疗成人复发型多发性硬化(RMS),包括临床孤立综合征、复发缓解性疾病、活动性继发进展性疾病。2020年5月,Zeposia获得欧盟委员会批准,用于治疗有活动性疾病(定义为:有临床或影像学特征)的复发-缓解型多发性硬化(RRMS)成人患者。
目前,百时美施贵宝正在开发Zeposia用于多种免疫炎症适应症,除了多发性硬化(MS)和溃疡性结肠炎(UC)之外,还包括克罗恩病(CD)。III期YELLOWSTONE临床试验项目正在评估Zeposia治疗中度至重度活动性CD患者。Zeposia治疗UC和CD的机制尚不清楚,但可能与减少淋巴细胞进入炎症肠粘膜有关。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



