Nature:新研究揭示人如其食背后的秘密!饮食通过肠道细菌影响宿主免疫系统
来源:本站原创 2021-11-22 16:14
在一项新的研究中,来自美国哈佛医学院、布莱根妇女医院、韩国首尔国立大学和澳大利亚莫纳什大学的研究人员找到了“人如其食”这一概念的分子证据,证明了饮食如何通过肠道微生物组最终影响免疫力。
2021年11月22日讯/生物谷BIOON/---几百年来,“人如其食(you are what you eat)”这一陈词滥调一直被用来说明饮食与健康之间的联系。如今,在一项新的研究中,来自美国哈佛医学院、布莱根妇女医院、韩国首尔国立大学和澳大利亚莫纳什大学的研究人员找到了这一概念的分子证据,证明了饮食如何通过肠道微生物组最终影响免疫力。相关研究结果于2021年11月10日在线发表在Nature期刊上,论文标题为“Host immunomodulatory lipids created by symbionts from dietary amino acids”。

这项在小鼠身上进行的研究显示,这些动物食用的东西会启动一种特定肠道微生物的代谢副产物的释放,而这种副产物反过来又会调节它们的肠道免疫力。这些发现为饮食、肠道微生物群和免疫功能之间复杂的相互作用提供了统一的解释。
他们的实验确定了一种微生物分子,它的合成和释放受到宿主饮食的影响。该分子反过来又刺激称为自然杀伤性T细胞(NK T细胞)的免疫细胞亚群的激活和信号传递,其中NK T细胞参与免疫调节并与一系列炎症性疾病有关。
论文共同通讯作者、哈佛医学院布拉瓦尼克研究所免疫学教授Dennis Kasper说,虽然科学家们长期以来一直猜测饮食在免疫健康中发挥着作用,但是这项新研究阐明了这种相互作用背后的精确分子级联反应。
Kasper说,“我们展示了饮食如何通过肠道中的一种微生物媒介影响免疫系统,这是一个真正引人注目的例子,说明饮食-微生物-免疫三者之间在起作用。这项研究真正做的是提供了一个从头到尾的逐步途径,解释了这三者如何以及为何发挥作用,以及饮食如何最终影响免疫系统。”
这些作者表示,如果在更大的动物身上得到证实,并最终在人类身上得到证实,这些发现可能有助于为设计提高肠道免疫力和整体免疫力的小分子疗法提供信息。
论文共同通讯作者兼论文共同第一作者、布莱根妇女医院实验治疗与再灌注损伤中心首席研究员、Kasper实验室前博士后研究员Sungwhan Oh说,“肠道驻留的微生物产生的分子具有巨大的结构多样性。我们的发现产生了关于肠道微生物组、饮食和免疫功能的迷人见解,并提供了关于我们内部邻居制造的分子如何用于设计新疗法的有趣线索。”
在一系列的实验中,Kasper及其团队确定了由小鼠肠道中膳食氨基酸的代谢分解所引发的免疫信号级联反应。这条多步骤的途径始于动物摄入含有支链氨基酸的食物。支链氨基酸随后被驻留在肠道中的微生物脆弱拟杆菌(Bacteroides fragilis)吸收,并被一种特定的酶转化为也有支链的糖脂分子(下称支链糖脂分子)。脆弱杆菌接着释放出这类支链糖脂分子,它们被一类称为抗原呈递细胞的免疫信号传导细胞发现并捕获,这反过来又诱导NK T细胞通过上调炎症控制基因和免疫调节性化学物来行使它们的免疫调节反应。
值得注意的是,这些实验表明是这类支链糖脂分子的支链启动了这一级联反应。这类支链糖脂分子的直链版本(也就是不含有支链的糖脂分子)并没有产生同样的效果。此外,Kasper团队发现,脆弱拟杆菌改变了它所代谢的这些糖脂分子的结构,使它们更有能力与特定免疫细胞表面上的受体结合,并启动一个信号级联反应,最终达到降低炎症的目的。
这项新的研究还表明,小鼠摄入的三种不同的支链氨基酸中的每一种都会对这些细菌糖脂分子产生略微不同的结构变化,从而导致与免疫细胞的不同结合模式。
论文共同通讯作者、首尔国立大学化学教授Seung Bum Park合成了23种不同结构的微生物免疫调节分子,Kasper团队对其进行了测试,以确定每种分子如何与调节炎症的免疫细胞相互作用。
Kasper团队的实验显示,合成的、实验室制造的支链糖脂分子诱导NK T细胞释放免疫信号化学物IL-2,而实验室制造的这些支链糖脂分子的直链版本则没有产生同样的效果。这样一来,NK T细胞被激活,这反过来诱导了调节免疫力的基因的表达,而不是驱动炎症的基因的表达。
论文共同通讯作者、莫纳什大学生物医学发现研究所生物化学与分子生物学教授Jamie Rossjohn利用结构生物学方法阐明了这种支链糖脂分子结构如何与抗原呈递细胞---激活NK T细胞以产生抗炎化学物的免疫细胞---接触并结合。
在最后一步,这些作者用这类支链糖脂分子治疗患有溃疡性结肠炎的小鼠。接受这类支链糖脂分子治疗的小鼠比未接受治疗的小鼠情况好得多。它们不仅体重增加,而且当这些作者在显微镜下检查它们的肠道细胞时,他们观察到它们的肠道细胞具有最小的结肠炎症迹象。
综上所述,这些实验为以前观察到的由肠道微生物脆弱拟杆菌产生的这一类支链糖脂分子的抗炎作用提供了结构和分子上的解释。
Rossjohn说,“这项新的研究提供了一个基于发现的跨学科研究的极佳例子,旨在回答生物医学科学中的一个主要问题,即免疫系统如何被饮食和肠道微生物群之间的相互作用所调控。”
2014年,Kasper及其同事们发表的一项研究已显示,脆弱拟杆菌释放的一类糖脂分子对肠道有抗炎作用,并保护小鼠免受结肠炎影响,但科学家们并不知道这类分子是如何由肠道微生物制造的,也不知道赋予抗炎作用的糖脂分子的具体结构特征。这项新的研究回答了这个问题,证实这种特殊肠道微生物制造的糖脂分子是支链的,正是这种支链结构使它们能够以一种抑制这些细胞的促炎信号传导的方式与免疫细胞结合。
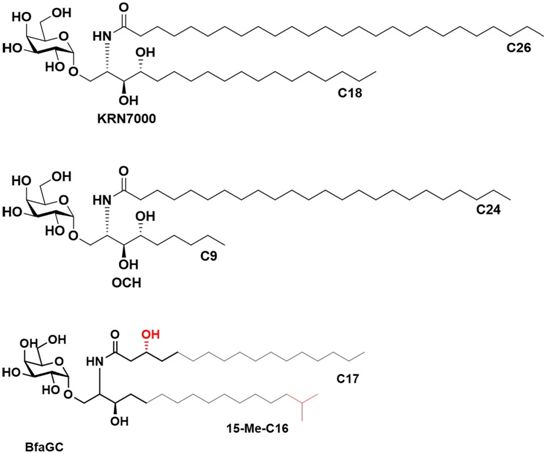
NK T细胞激动剂KRN7000、OCH和脆弱拟杆菌衍生的aGC(SB2217)的分子结构,图片来自Nature, 2021, doi:10.1038/s41586-021-04083-0。
Kasper说,“我们的新研究表明,这类糖脂分子的支链结构诱发了一种非常不同的反应---这种支链结构诱发了一种抗炎反应而不是一种促炎反应。”
这些作者表示,这些发现为由这些NK T细胞介导的炎症性疾病有朝一日能用实验室制造的炎症抑制性微生物分子进行治疗带来了希望。
Kasper说,NK T细胞---微生物产生的支链糖脂分子最终激活控制小鼠结肠炎症的免疫细胞---的确切功能还不甚明了。然而,鉴于这些免疫细胞分布在人类的胃肠道和肺部,并在肝脏和脾脏中发现,它们可能在免疫调节中发挥重要作用。以前的研究已指出,这些免疫细胞可能参与了一系列的炎症,包括溃疡性结肠炎,并可能在气道炎症中发挥作用,如哮喘。
Kasper说,“我们永远无法从细菌中分离出足够多的这些免疫调节分子用于治疗,但其美妙之处在于如今我们可以在实验室中合成它们。我们的想法是,我们会有一种可以调节结肠和其他部位中的炎症的药物。”(生物谷 Bioon.com)
参考资料:
Sungwhan F. Oh et al. Host immunomodulatory lipids created by symbionts from dietary amino acids. Nature, 2021, doi:10.1038/s41586-021-04083-0.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



