转移性去势抵抗性前列腺癌一线治疗突破性进展,利普卓和阿比特龙联合疗法比标准疗法降低疾病进展风险达34%
来源:生物谷 2022-02-17 11:26
一线治疗转移性去势抵抗性前列腺癌(mCRPC)患者,与目前的标准治疗阿比特龙相比,无论同源重组修复(HRR)基因突变状态,影像学无进展生存期(rPFS)达到统计学意义和临床意义的改善。
前列腺癌是男性第二大常见癌症,在2020 年导致约 375,000 人死亡。晚期前列腺癌患者预后很差,五年生存率一直较低。大约一半的 mCRPC 患者只接受过一线有效治疗,后续治疗的获益有限。大约 20-30% 的 mCRPC 患者携带HRR基因突变。
2月17日, 2022 年美国临床肿瘤学会(ASCO)泌尿生殖系统癌症研讨会上公布了,PROpel III 期临床试验阳性结果,显示阿斯利康(AstraZeneca)和默沙东(MSD)合作开发的奥拉帕利(商品名利普卓)与阿比特龙联合用药,一线治疗转移性去势抵抗性前列腺癌(mCRPC)患者,与目前的标准治疗阿比特龙相比,无论同源重组修复(HRR)基因突变状态,影像学无进展生存期(rPFS)达到统计学意义和临床意义的改善。
PROpel III 期是一项随机、双盲、多中心临床试验,在之前未接受过化疗或 NHA 等一线治疗的 mCRPC患者中评估在阿比特龙的基础上,奥拉帕利与安慰剂相比的疗效、安全性和耐受性。两个治疗组中的患者还将每天接受两次泼尼松或泼尼松龙。临床主要终点是 rPFS,次要终点包括 OS、PFS2 和 TFST。
PROpel试验的首席研究员,蒙特利尔大学医疗中心泌尿外科主任,泌尿生殖肿瘤科主管Fred Saad 教授说: “我很清楚, mCRPC患者的预后极差,而许多患者只接受一种有效治疗。 PROpel 试验结果表明,与阿比特龙相比,奥拉帕利联合阿比特龙显著延迟疾病进展超过 8 个月,这表明如果获得批准,该联合疗法有可能成为一种新的 mCRPC标准疗法。”
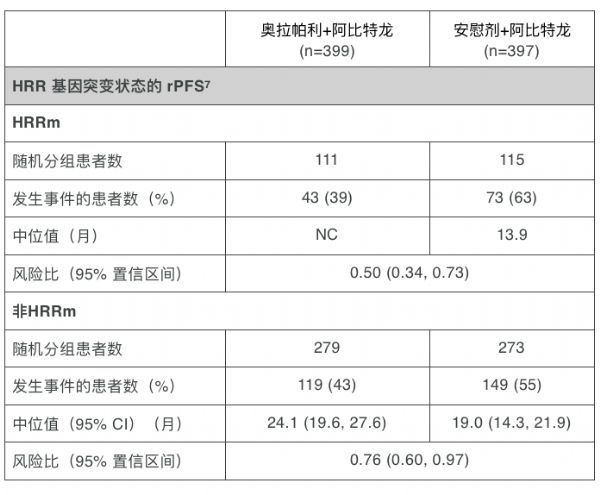
阿斯利康肿瘤研发执行副总裁 Susan Galbraith 表示:“这种奥拉帕利联合疗法有可能让一线患者更长时间处于疾病不发生进展的状态,同时还保持生活质量。由于试验设定了标准治疗作为对照这样一个高标准,因此PROpel 试验结果令人印象深刻:与有效的标准治疗相比,无论mCRPC患者是否携带HRR基因突变,奥拉帕利和阿比特龙联合疗法都显示出显著的临床改善。”
默沙东实验室全球临床研究高级副总裁、首席医学官贝罗毅博士(Roy Baynes)强调:“PROpel 试验结果表明,对于转移性去势抵抗性前列腺癌患者,无论其生物标志物状态如何,与阿比特龙加泼尼松相比,奥拉帕利联合阿比特龙加泼尼松可将疾病进展或死亡风险降低1/3。我们期待尽快与全球医药监管部门讨论这些重要结果,衷心感谢参与这项研究的患者、家属和医护人员们。”
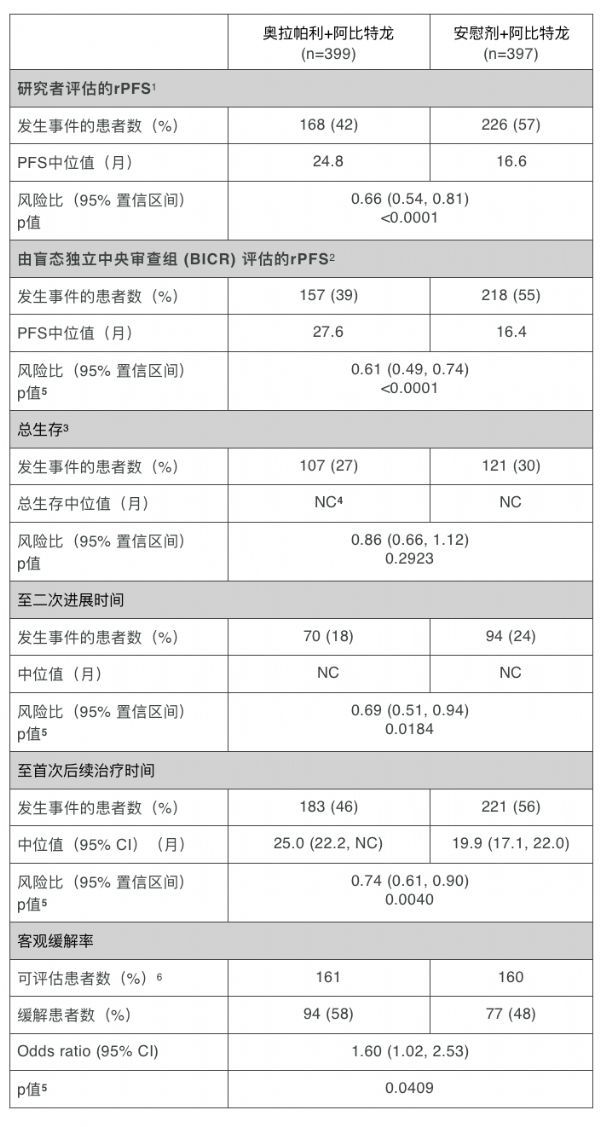
在一项预先设定的中期分析中,与单独使用阿比特龙相比,奥拉帕利联合阿比特龙将疾病进展或死亡风险降低了 34%(风险比 [HR] 0.66;95% 置信区间 [CI] 0.54-0.81;p< 0.0001)。 奥拉帕利联合阿比特龙组的中位 rPFS为24.8 个月,而阿比特龙单药组rPFS为 16.6 个月。
结果还显示,与单独使用阿比特龙相比,奥拉帕利联合阿比特龙有改善总生存(OS)的有利趋势,但在数据截止时该趋势未达到统计学意义上的差异(数据成熟度为29%)。该试验将把OS 作为关键的次要终点继续进行评估。
来自其他临床有效性终点的数据,如至首次后续治疗时间(TFST)、至二次进展时间(PFS2)、客观缓解率(ORR),以及前列腺特异性抗原水平和循环系统肿瘤细胞计数,都进一步支持在整个试验人群中,与单独使用阿比特龙相比,奥拉帕利和阿比特龙联合疗法的治疗获益。
奥拉帕利和阿比特龙联合疗法的安全性和耐受性与先前临床试验中观察到的结果,以及单药治疗的已知特征一致。与单独接受阿比特龙治疗的患者相比,奥拉帕利联合阿比特龙治疗的患者阿比特龙的停药率没有增加,并且对健康相关的生活质量没有不利影响(FACT-P:前列腺癌治疗功能评估问卷)。
PROpel试验结果概要
1. 研究者评估的无进展生存期数据; 50% 成熟度的中期分析(796 名患者中的 394 次事件)
2. 由盲态独立中央审查组 (BICR) 评估
3. OS 分析在 29% 的成熟度(796 名患者中的 228 次事件)和显著性边界 0.001(双侧)进行;未达到统计学意义上的显著性。生存期随访仍在继续,并计划进行进一步分析。
4. 无法统计
5.很小
6. 可检测疾病患者基线设定是根据 RECIST 1.1 标准进行,由研究者评估。
7. 按 HRR 状态进行探索性亚组分析。 PROpel 患者的 HRRm 状态是由使用肿瘤组织和血浆 ctDNA 样本的回顾性检测结果确定的。如果通过任一样本检测到(一个或多个)HRR基因突变,则将患者分类为HRRm;如果任一样本均未检测到HRR基因突变,则将患者分类为非HRRm;18名患者的肿瘤组织或 ctDNA样本检测均未获得有效的HRR检测结果,因此被排除在亚组分析之外。使用Cox比例风险模型进行分析,包括治疗组、其他亚组因素和亚组互动治疗。
在安全性方面,最常见的不良事件(AE)(大于或等于 20% 的患者)是贫血(45%)、恶心(28%)和疲劳(28%)。 3 级或以上的AE 为贫血(15%)、高血压(4%)、尿路感染(2%)、疲劳 (1%)、食欲下降(1%)、呕吐(1%)、虚弱(1%)、背痛(1%),和腹泻(1%)。在数据截止时,约 86% 接受奥拉帕利联合阿比特龙治疗且出现 AE 的患者仍在接受治疗。
2021年9月,在预设中期分析中,独立数据监测委员会得出结论:PROpel 试验达到了 rPFS 的主要终点。
奥拉帕利在美国被批准用于携带HRR 基因突变的 mCRPC(BRCA 突变和其他 HRR 基因突变)患者;在欧盟、日本和中国获准用于携带BRCA突变的mCRPC患者。
关于转移性去势抵抗性前列腺癌
转移性前列腺癌与高死亡率相关。前列腺癌进展通常由包括睾酮在内的雄性激素驱动 。在 mCRPC 患者中,尽管使用雄激素剥夺疗法来阻断雄性激素的作用,但前列腺癌仍会进展并扩散到身体其他部位。大约 10-20%的晚期前列腺癌患者会在五年内进展为去势抵抗性前列腺癌(CRPC),并且其中至少有 84% 的患者在诊断为CRPC时已经发生了转移。
在诊断为CRPC时没有转移的患者中有33% 的患者可能在两年内发生转移11。尽管过去十多年 mCRPC 治疗因为使用紫杉烷和新型内分泌类药物(NHA)取得了进展,但一旦患者一线治疗失败,二线治法的效果显著下降,该人群的医疗需求未能得到满足。
关于奥拉帕利
奥拉帕利是PARP抑制剂类首创新药,是首个在同源重组修复(HRR)缺陷肿瘤细胞中阻断 DNA 损伤应答(DDR)的靶向治疗药物,HRR缺陷包括如BRCA1/BRCA2突变,或由其他药物(如 NHA)引起的功能缺陷。
奥拉帕利等PARP抑制剂可导致PARP被捕获在断裂的DNA单链处,复制叉停滞,出现DNA双链断裂,最终导致肿瘤细胞死亡。在 PROpel III 期临床试验中,奥拉帕利与靶向雄激素受体(AR)通路的NHA阿比特龙联合使用。
雄激素受体信号参与的转录过程对前列腺癌中的肿瘤细胞生长和存活至关重要15,16。临床前模型已经确定了 PARP和 AR 通路之间有协同作用,支持在HRR缺陷型和野生型前列腺癌患者中进行奥拉帕利和NHA(如阿比特龙)的联合治疗。
有研究表明雄激素受体转录活性受到PARP1 调节;奥拉帕利抑制PARP活性可能会降低雄激素受体靶基因的表达,从而增强 NHA 的活性。此外,阿比特龙可能会改变或抑制某些 HRR 基因的转录,这可能会诱导 HRR功能缺陷,增强对PARP抑制剂的敏感性。
奥拉帕利目前已经在多个国家地区获批用于在 DDR 通路中存在缺陷的PARP 依赖性肿瘤,包括作为单一疗法用于铂敏感复发性卵巢癌的维持治疗,以及与贝伐单抗联合用于携带BRCA 突变(BRCAm)和同源重组缺陷(HRD)晚期卵巢癌的一线维持治疗。
奥拉帕利还被批准用于携带BRCAm、HER2 阴性转移性乳腺癌(在欧盟包括局部晚期乳腺癌);用于携带胚系 BRCAm 的转移性胰腺癌和携带HRR 基因突变的转移性去势抵抗性前列腺癌(在欧盟和日本获批适应症为携带BRCAm)。
参考资料
1. IARC. Cancer Today – Estimated number of new cases in 2020, worldwide, both sexes, all ages. Available at https://gco.iarc.fr/today/home. Accessed January 2022.
2. Moreira D, et al. Predicting Time From Metastasis to Overall Survival in Castration-Resistant Prostate Cancer: Results From SEARCH. Clin Genitourin Cancer. 2017;15(1):60-66.e2.
3. Chowdhury S, et al. Real-world outcomes in first-line treatment of metastatic castration-resistant prostate cancer: the prostate cancer registry. Target Oncol. 2020;15(3):301-15.
4. George DJ, et al. Treatment Patterns and Outcomes in Patients With Metastatic Castration-resistant Prostate Cancer in a Real-world Clinical Practice Setting in the United States. Clin Genitourin Cancer. 2020; 18(4):284-294.
5. de Bono JS, et al. Subsequent Chemotherapy and Treatment Patterns After Abiraterone Acetate in Patients with Metastatic Castration-resistant Prostate Cancer: Post Hoc Analysis of COU-AA-302. Eur Urol. 2017;71(4):656-664.
6. Ryan CJ, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015;16(2):152-160.
7. Beer TM, et al. Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol. 2017;71(2):151-154
8. Mateo, J, et al (2015). DNA-repair defects and olaparib in metastatic prostate cancer. The New England Journal of Medicine, 373(18), pp.1697 - 1708.
9. Cancer.Net. Treatment of metastatic castration-resistant prostate cancer. Available at www.cancer.net/research-and-advocacy/asco-care-and-treatment-recommendations-patients/treatment-metastatic-castration-resistant-prostate-cancer. Accessed January 2022.
10. Kirby, M, et al. Characterising the castration-resistant prostate cancer population: a systematic review. International Journal of Clinical Practice, 2021;65(11):1180-1192.
11. Smith MR, et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J Clin Oncol. 2005;23(13):2918-25.
12. UroToday. What is Changing in Advanced Prostate Cancer? Available at https://www.urotoday.com/journal/everyday-urology-oncology-insights/articles/122176-what-is-changing-in-advanced-prostate-cancer.html. Accessed January 2022.
13. Liu J, et al. Second-line Hormonal Therapy for the Management of Metastatic Castration-resistant Prostate Cancer: a Real-World Data Study Using a Claims Database. Scientific Report. 2020;10(4240):2020.
14. UroToday. Beyond First-line Treatment of Metastatic Castrate-resistant Prostate Cancer. Available at https://www.urotoday.com/library-resources/mcrpc-treatment/114592-beyond-first-line-treatment-of-metastatic-castrate-resistant-prostate-cancer.html. Accessed January 2022.
15. Schiewer MJ, et al. Dual roles of PARP-1 promote cancer growth and progression. Cancer Discov. 2012;2(12):1134-1149.
16. Schiewer MJ & Knudsen KE. AMPed up to treat prostate cancer: novel AMPK activators emerge for cancer therapy. EMBO Mol Med. 2014;6(4):439-441.
17. Li L, et al. Androgen receptor inhibitor–induced “BRCAness” and PARP inhibition are synthetically lethal for castration-resistant prostate cancer. Sci Signal. 2017; 10(480):eaam7479.
18. Polkinghorn WR, et al. Androgen receptor signaling regulates DNA repair in prostate cancers. Cancer Discov. 2013;3(11):1245-1253.
19. Asim M, et al. Synthetic lethality between androgen receptor signalling and the PARP pathway in prostate cancer. Nat Commun. 2017;374(8).
20. Ju B-G, et al. A topoisomerase IIbeta-mediated dsDNA break required for regulated transcription. Science. 2006;312(5781):1798-1802.
21. Goodwin JF, et al. A hormone-DNA repair circuit governs the response to genotoxic insult. Cancer Discov. 2013;3(11):1254-1271.
22. Tarish FL, et al. Castration radiosensitizes prostate cancer tissue by impairing DNA double-strand break repair. Sci Transl Med. 2015; 7(312):312re11.
2月17日, 2022 年美国临床肿瘤学会(ASCO)泌尿生殖系统癌症研讨会上公布了,PROpel III 期临床试验阳性结果,显示阿斯利康(AstraZeneca)和默沙东(MSD)合作开发的奥拉帕利(商品名利普卓)与阿比特龙联合用药,一线治疗转移性去势抵抗性前列腺癌(mCRPC)患者,与目前的标准治疗阿比特龙相比,无论同源重组修复(HRR)基因突变状态,影像学无进展生存期(rPFS)达到统计学意义和临床意义的改善。
PROpel III 期是一项随机、双盲、多中心临床试验,在之前未接受过化疗或 NHA 等一线治疗的 mCRPC患者中评估在阿比特龙的基础上,奥拉帕利与安慰剂相比的疗效、安全性和耐受性。两个治疗组中的患者还将每天接受两次泼尼松或泼尼松龙。临床主要终点是 rPFS,次要终点包括 OS、PFS2 和 TFST。
PROpel试验的首席研究员,蒙特利尔大学医疗中心泌尿外科主任,泌尿生殖肿瘤科主管Fred Saad 教授说: “我很清楚, mCRPC患者的预后极差,而许多患者只接受一种有效治疗。 PROpel 试验结果表明,与阿比特龙相比,奥拉帕利联合阿比特龙显著延迟疾病进展超过 8 个月,这表明如果获得批准,该联合疗法有可能成为一种新的 mCRPC标准疗法。”
阿斯利康肿瘤研发执行副总裁 Susan Galbraith 表示:“这种奥拉帕利联合疗法有可能让一线患者更长时间处于疾病不发生进展的状态,同时还保持生活质量。由于试验设定了标准治疗作为对照这样一个高标准,因此PROpel 试验结果令人印象深刻:与有效的标准治疗相比,无论mCRPC患者是否携带HRR基因突变,奥拉帕利和阿比特龙联合疗法都显示出显著的临床改善。”
默沙东实验室全球临床研究高级副总裁、首席医学官贝罗毅博士(Roy Baynes)强调:“PROpel 试验结果表明,对于转移性去势抵抗性前列腺癌患者,无论其生物标志物状态如何,与阿比特龙加泼尼松相比,奥拉帕利联合阿比特龙加泼尼松可将疾病进展或死亡风险降低1/3。我们期待尽快与全球医药监管部门讨论这些重要结果,衷心感谢参与这项研究的患者、家属和医护人员们。”
在一项预先设定的中期分析中,与单独使用阿比特龙相比,奥拉帕利联合阿比特龙将疾病进展或死亡风险降低了 34%(风险比 [HR] 0.66;95% 置信区间 [CI] 0.54-0.81;p< 0.0001)。 奥拉帕利联合阿比特龙组的中位 rPFS为24.8 个月,而阿比特龙单药组rPFS为 16.6 个月。
结果还显示,与单独使用阿比特龙相比,奥拉帕利联合阿比特龙有改善总生存(OS)的有利趋势,但在数据截止时该趋势未达到统计学意义上的差异(数据成熟度为29%)。该试验将把OS 作为关键的次要终点继续进行评估。
来自其他临床有效性终点的数据,如至首次后续治疗时间(TFST)、至二次进展时间(PFS2)、客观缓解率(ORR),以及前列腺特异性抗原水平和循环系统肿瘤细胞计数,都进一步支持在整个试验人群中,与单独使用阿比特龙相比,奥拉帕利和阿比特龙联合疗法的治疗获益。
奥拉帕利和阿比特龙联合疗法的安全性和耐受性与先前临床试验中观察到的结果,以及单药治疗的已知特征一致。与单独接受阿比特龙治疗的患者相比,奥拉帕利联合阿比特龙治疗的患者阿比特龙的停药率没有增加,并且对健康相关的生活质量没有不利影响(FACT-P:前列腺癌治疗功能评估问卷)。
PROpel试验结果概要


1. 研究者评估的无进展生存期数据; 50% 成熟度的中期分析(796 名患者中的 394 次事件)
2. 由盲态独立中央审查组 (BICR) 评估
3. OS 分析在 29% 的成熟度(796 名患者中的 228 次事件)和显著性边界 0.001(双侧)进行;未达到统计学意义上的显著性。生存期随访仍在继续,并计划进行进一步分析。
4. 无法统计
5.很小
6. 可检测疾病患者基线设定是根据 RECIST 1.1 标准进行,由研究者评估。
7. 按 HRR 状态进行探索性亚组分析。 PROpel 患者的 HRRm 状态是由使用肿瘤组织和血浆 ctDNA 样本的回顾性检测结果确定的。如果通过任一样本检测到(一个或多个)HRR基因突变,则将患者分类为HRRm;如果任一样本均未检测到HRR基因突变,则将患者分类为非HRRm;18名患者的肿瘤组织或 ctDNA样本检测均未获得有效的HRR检测结果,因此被排除在亚组分析之外。使用Cox比例风险模型进行分析,包括治疗组、其他亚组因素和亚组互动治疗。
在安全性方面,最常见的不良事件(AE)(大于或等于 20% 的患者)是贫血(45%)、恶心(28%)和疲劳(28%)。 3 级或以上的AE 为贫血(15%)、高血压(4%)、尿路感染(2%)、疲劳 (1%)、食欲下降(1%)、呕吐(1%)、虚弱(1%)、背痛(1%),和腹泻(1%)。在数据截止时,约 86% 接受奥拉帕利联合阿比特龙治疗且出现 AE 的患者仍在接受治疗。
2021年9月,在预设中期分析中,独立数据监测委员会得出结论:PROpel 试验达到了 rPFS 的主要终点。
奥拉帕利在美国被批准用于携带HRR 基因突变的 mCRPC(BRCA 突变和其他 HRR 基因突变)患者;在欧盟、日本和中国获准用于携带BRCA突变的mCRPC患者。
关于转移性去势抵抗性前列腺癌
转移性前列腺癌与高死亡率相关。前列腺癌进展通常由包括睾酮在内的雄性激素驱动 。在 mCRPC 患者中,尽管使用雄激素剥夺疗法来阻断雄性激素的作用,但前列腺癌仍会进展并扩散到身体其他部位。大约 10-20%的晚期前列腺癌患者会在五年内进展为去势抵抗性前列腺癌(CRPC),并且其中至少有 84% 的患者在诊断为CRPC时已经发生了转移。
在诊断为CRPC时没有转移的患者中有33% 的患者可能在两年内发生转移11。尽管过去十多年 mCRPC 治疗因为使用紫杉烷和新型内分泌类药物(NHA)取得了进展,但一旦患者一线治疗失败,二线治法的效果显著下降,该人群的医疗需求未能得到满足。
关于奥拉帕利
奥拉帕利是PARP抑制剂类首创新药,是首个在同源重组修复(HRR)缺陷肿瘤细胞中阻断 DNA 损伤应答(DDR)的靶向治疗药物,HRR缺陷包括如BRCA1/BRCA2突变,或由其他药物(如 NHA)引起的功能缺陷。
奥拉帕利等PARP抑制剂可导致PARP被捕获在断裂的DNA单链处,复制叉停滞,出现DNA双链断裂,最终导致肿瘤细胞死亡。在 PROpel III 期临床试验中,奥拉帕利与靶向雄激素受体(AR)通路的NHA阿比特龙联合使用。
雄激素受体信号参与的转录过程对前列腺癌中的肿瘤细胞生长和存活至关重要15,16。临床前模型已经确定了 PARP和 AR 通路之间有协同作用,支持在HRR缺陷型和野生型前列腺癌患者中进行奥拉帕利和NHA(如阿比特龙)的联合治疗。
有研究表明雄激素受体转录活性受到PARP1 调节;奥拉帕利抑制PARP活性可能会降低雄激素受体靶基因的表达,从而增强 NHA 的活性。此外,阿比特龙可能会改变或抑制某些 HRR 基因的转录,这可能会诱导 HRR功能缺陷,增强对PARP抑制剂的敏感性。
奥拉帕利目前已经在多个国家地区获批用于在 DDR 通路中存在缺陷的PARP 依赖性肿瘤,包括作为单一疗法用于铂敏感复发性卵巢癌的维持治疗,以及与贝伐单抗联合用于携带BRCA 突变(BRCAm)和同源重组缺陷(HRD)晚期卵巢癌的一线维持治疗。
奥拉帕利还被批准用于携带BRCAm、HER2 阴性转移性乳腺癌(在欧盟包括局部晚期乳腺癌);用于携带胚系 BRCAm 的转移性胰腺癌和携带HRR 基因突变的转移性去势抵抗性前列腺癌(在欧盟和日本获批适应症为携带BRCAm)。
参考资料
1. IARC. Cancer Today – Estimated number of new cases in 2020, worldwide, both sexes, all ages. Available at https://gco.iarc.fr/today/home. Accessed January 2022.
2. Moreira D, et al. Predicting Time From Metastasis to Overall Survival in Castration-Resistant Prostate Cancer: Results From SEARCH. Clin Genitourin Cancer. 2017;15(1):60-66.e2.
3. Chowdhury S, et al. Real-world outcomes in first-line treatment of metastatic castration-resistant prostate cancer: the prostate cancer registry. Target Oncol. 2020;15(3):301-15.
4. George DJ, et al. Treatment Patterns and Outcomes in Patients With Metastatic Castration-resistant Prostate Cancer in a Real-world Clinical Practice Setting in the United States. Clin Genitourin Cancer. 2020; 18(4):284-294.
5. de Bono JS, et al. Subsequent Chemotherapy and Treatment Patterns After Abiraterone Acetate in Patients with Metastatic Castration-resistant Prostate Cancer: Post Hoc Analysis of COU-AA-302. Eur Urol. 2017;71(4):656-664.
6. Ryan CJ, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015;16(2):152-160.
7. Beer TM, et al. Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol. 2017;71(2):151-154
8. Mateo, J, et al (2015). DNA-repair defects and olaparib in metastatic prostate cancer. The New England Journal of Medicine, 373(18), pp.1697 - 1708.
9. Cancer.Net. Treatment of metastatic castration-resistant prostate cancer. Available at www.cancer.net/research-and-advocacy/asco-care-and-treatment-recommendations-patients/treatment-metastatic-castration-resistant-prostate-cancer. Accessed January 2022.
10. Kirby, M, et al. Characterising the castration-resistant prostate cancer population: a systematic review. International Journal of Clinical Practice, 2021;65(11):1180-1192.
11. Smith MR, et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J Clin Oncol. 2005;23(13):2918-25.
12. UroToday. What is Changing in Advanced Prostate Cancer? Available at https://www.urotoday.com/journal/everyday-urology-oncology-insights/articles/122176-what-is-changing-in-advanced-prostate-cancer.html. Accessed January 2022.
13. Liu J, et al. Second-line Hormonal Therapy for the Management of Metastatic Castration-resistant Prostate Cancer: a Real-World Data Study Using a Claims Database. Scientific Report. 2020;10(4240):2020.
14. UroToday. Beyond First-line Treatment of Metastatic Castrate-resistant Prostate Cancer. Available at https://www.urotoday.com/library-resources/mcrpc-treatment/114592-beyond-first-line-treatment-of-metastatic-castrate-resistant-prostate-cancer.html. Accessed January 2022.
15. Schiewer MJ, et al. Dual roles of PARP-1 promote cancer growth and progression. Cancer Discov. 2012;2(12):1134-1149.
16. Schiewer MJ & Knudsen KE. AMPed up to treat prostate cancer: novel AMPK activators emerge for cancer therapy. EMBO Mol Med. 2014;6(4):439-441.
17. Li L, et al. Androgen receptor inhibitor–induced “BRCAness” and PARP inhibition are synthetically lethal for castration-resistant prostate cancer. Sci Signal. 2017; 10(480):eaam7479.
18. Polkinghorn WR, et al. Androgen receptor signaling regulates DNA repair in prostate cancers. Cancer Discov. 2013;3(11):1245-1253.
19. Asim M, et al. Synthetic lethality between androgen receptor signalling and the PARP pathway in prostate cancer. Nat Commun. 2017;374(8).
20. Ju B-G, et al. A topoisomerase IIbeta-mediated dsDNA break required for regulated transcription. Science. 2006;312(5781):1798-1802.
21. Goodwin JF, et al. A hormone-DNA repair circuit governs the response to genotoxic insult. Cancer Discov. 2013;3(11):1254-1271.
22. Tarish FL, et al. Castration radiosensitizes prostate cancer tissue by impairing DNA double-strand break repair. Sci Transl Med. 2015; 7(312):312re11.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


