2021年9月Cell期刊不得不看的亮点研究
来源:本站原创 2021-09-30 23:58
2021年9月30日讯/生物谷BIOON/---2021年9月份即将结束了,9月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:严格的谱系追踪对神经细胞再生研究至关重要doi:10.1016/j.cell.2021.09.005谱系追踪(lineage tracing)是发育生物学的一个基本方法,指的是用于绘制有机体内
2021年9月30日讯/生物谷BIOON/---2021年9月份即将结束了,9月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:严格的谱系追踪对神经细胞再生研究至关重要
doi:10.1016/j.cell.2021.09.005
谱系追踪(lineage tracing)是发育生物学的一个基本方法,指的是用于绘制有机体内特定细胞的后代的测试方法。在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现严格的谱系追踪对神经细胞再生的研究至关重要。他们的研究结果显示这种追踪方法远非该领域的常规做法,并建议必须重新审视之前报告的取得“引人注目”的再生结果的研究。相关研究结果于2021年9月27日在线发表在Cell期刊上,论文标题为“Revisiting astrocyte to neuron conversion with lineage tracing in vivo”。
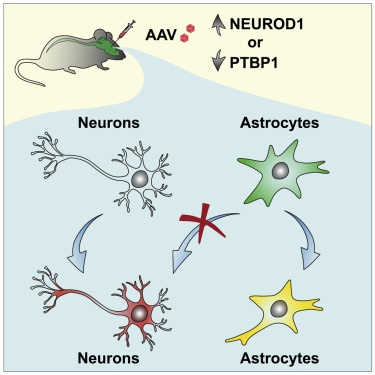
图片来自Cell, 2021, doi:10.1016/j.cell.2021.09.005。
在使用一系列方案进行了数十次实验后,这些作者确定了哪些特定的谱系追踪测试方法似乎是最强大和最可靠的---所谓的黄金标准测试方法。Zhang博士说,“我们采用了目前可用的谱系追踪测试方法。我们没有开发新的方法。”他们还确定了那些不太可能提供精确结果的测试方法。
这项新的研究还列出了可靠的谱系追踪测试方法,并强烈建议在所有进行神经细胞再生研究的实验室中使用这些测试方法。他说,“我们列出的方法是在实验室中直接建立的,我们相信它们应该一直被使用。”
2.Cell:重大进展!鉴定出裂谷热病毒利用Lrp1蛋白进入宿主细胞
doi:10.1016/j.cell.2021.09.001
裂谷热病毒(rift valley fever virus, RVFV)导致绵羊、山羊和牛等牲畜爆发具有经济破坏性的出血热,即裂谷热。这种由蚊子传播的疾病爆发导致与死亡或濒临死亡的动物打交道的人受到感染,有时会造成数百人的病例和数十人的死亡。裂谷热没有特定的治疗方法,一直局限于非洲和阿拉伯半岛。但是能够传播该病毒的蚊子在世界各地都能找到,因此有必要了解和控制RVFV。在一项新的研究中,来自美国华盛顿大学圣路易斯医学院和匹兹堡大学的研究人员发现RVFV通过利用一种通常参与从血液中摄取低密度脂蛋白(LDL,所谓坏胆固醇的载体)的蛋白质进入细胞内部。这一发现可能会导致预防裂谷热的疗法,或通过干扰这种病毒进入细胞的能力减少它的影响。相关研究结果于2021年9月23日在线发表在Cell期刊上,论文标题为“Lrp1 is a host entry factor for Rift Valley fever virus”。
为了弄清这种病毒是如何入侵宿主细胞的,论文第一作者、与Amarasinghe合作的博士后研究员Safder Ganaie博士利用培养皿中的小鼠细胞培养这种病毒。通过系统地破坏小鼠的正常基因,Ganaie及其同事们发现,这种病毒无法感染缺乏某些基因的小鼠细胞,特别是编码低密度脂蛋白受体相关蛋白1(LDL receptor-related protein 1, Lrp1)的基因。进一步的实验显示,该病毒需要LRP1来感染小鼠、仓鼠、奶牛、猴和人类细胞,这就表明该病毒在不同的亲缘关系较远的物种中使用相同的蛋白质。
这一发现提供了一个机会。如果这种病毒需要LRP1来感染宿主细胞,那么暂时让LRP1失去作用可能会限制它在体内的传播能力,从而减少疾病。这些作者使用了一种能有效做到这一点的蛋白质。这种称为RAP的蛋白质附着在LRP1上,并阻挡其他试图附着上来的东西。
这些作者让这种病毒感染了一组小鼠,同时用RAP治疗它们。第二组小鼠也被这种病毒感染了,但没有进行RAP治疗以进行比较。大多数接受RAP治疗的小鼠存活下来,而所有未接受RAP治疗的小鼠都死亡。此外,与未经RAP治疗的小鼠相比,经过RAP治疗的小鼠在感染后第三天全身的病毒水平较低。
3.Cell:细胞核的破裂或会促进乳腺癌的侵袭和扩散!
doi:10.1016/j.cell.2021.08.035
尽管引发核膜受损的突变会诱发多种疾病,比如肌肉萎缩症或加速衰老等,但机械性地诱发核膜破裂的后果却并不为人所知;当细胞繁殖和迁移时去就会被压缩,从而导致细胞核破裂进而损伤DNA。近日,一篇发表在国际杂志Cell上题为“Compromised nuclear envelope integrity drives TREX1-dependent DNA damage and tumor cell invasion”的研究报告中,来自巴黎文理研究大学等机构的科学家们通过研究发现,细胞在繁殖和迁移过程中所诱发的DNA损伤或会促进乳腺肿瘤中癌细胞的扩散。
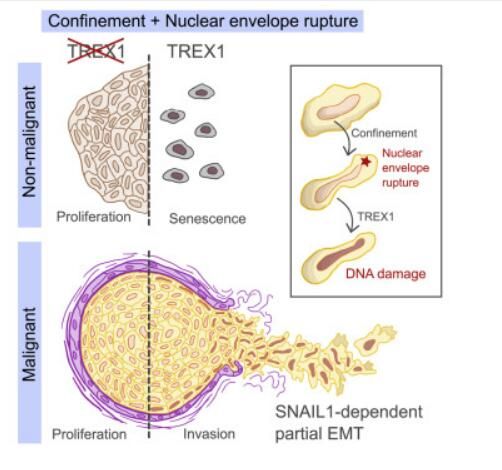
细胞核的破裂或会促进乳腺癌的侵袭和扩散。图片来源:Guilherme Pedreira de Freitas Nader,et al. Cell (2021). DOI:10.1016/j.cell.2021.08.035。
本文研究中,研究者发现,当细胞被压缩并引发细胞核破裂时,DNA就会接触到一种名为TREX1的DNA破坏酶,TREX1的正常功能就是通过破坏尝试感染细胞的病毒的DNA来保护细胞免受损伤,但在这些不寻常的条件下其反而会攻击细胞的DNA。在健康组织中,细胞会展现出衰老的迹象并开始停止分裂,然而,研究人员观察到,这在乳腺肿瘤中的后果或许是不同的,TREX1所造成的损伤非但没有杀死癌细胞,反而会使其更具侵袭性;比如,当肿瘤生长过快时,细胞就会被压缩随后获得能力来破坏环境从而入侵到附近的组织中,并增加细胞转移的风险。
4.Cell:揭示胰腺癌的独特蛋白基因组学特征有望开发出早期诊断和治疗这种癌症的新方法
doi:10.1016/j.cell.2021.08.023
在一项大型国际合作的研究中,来自美国约翰霍普金斯大学等多个研究机构的研究人员在研究胰腺癌的多个方面之后,确定了有希望的胰腺癌治疗和早期诊断的新靶标。他们的研究结果可能为患有这种致命疾病的患者带来希望。相关研究结果发表在2021年9月16日的Cell期刊上,论文标题为“Proteogenomic characterization of pancreatic ductal adenocarcinoma”。
为了寻找对抗胰腺癌的新方法,Zhang、Hruban、约翰霍普金斯大学医学院病理学教授Daniel W. Chan博士、博士后研究员Liwei Cao博士,以及来自约翰霍普金斯大学和全球其他机构的合作者从几个不同的角度对胰腺瘤进行了新的研究。他们将140个肿瘤样本与来自同一患者的67个正常邻近的胰腺组织样本,以及来自未患癌症的患者的9个胰腺组织样本进行了比较。这些作者研究了整个基因组、DNA编码序列、开启或关闭某些基因的DNA修饰、传递DNA信息的信使RNA(mRNA)分子,以及调节基因表达的微小RNA(microRNA)。他们分析了胰腺癌细胞中产生的蛋白质,包括对所产生的蛋白质的各种修饰,如添加可改变其功能的磷酸基团或糖分子。
这些作者证实,胰腺瘤更有可能在以前的研究中发现的几个基因中出现突变,包括KRAS、TP53、CDKN2A和SMAD4。此外,他们在胰腺癌细胞和正常细胞之间鉴定出222种蛋白质,它们的丰度至少增加了两倍;这些蛋白质中近5000个位点的磷酸化丰度模式增加;1700多个位点附着的碳水化合物(即糖基化修饰)增加了。
Zhang说,这些糖基化的蛋白质中有几种是胰腺癌细胞分泌出来的,这表明它们有可能在血液中被捕获以便早期诊断胰腺癌。此外,PAK1和PAK2---两种称为激酶的特定蛋白质,可将磷酸基团置于其他蛋白质上---在胰腺癌中出现调控失常,这可能为治疗这种疾病提供以前未被认识的靶标。有几种靶向PAK1的仍处于研究中的小分子抑制剂,为治疗胰腺瘤提供了潜在的途径。Zhang补充说,胰腺癌细胞和正常胰腺组织之间的其他蛋白质差异似乎是阻碍免疫系统攻击的路障,这表明可能有新的方法来改善对胰腺瘤的免疫反应。
5.Cell:促进癌症的雌激素受体ERα也会导致癌症抗药性
doi:10.1016/j.cell.2021.08.036
尽管遭受无数的会杀死任何正常细胞的应激---从缺氧到化疗,但是癌细胞还是会增殖。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员深入了解了它们如何通过一种强大的雌激素受体的下游活性来实现这一点。这一发现为克服许多类型的乳腺癌对他莫西芬等药物产生的抗药性提供了线索。相关研究结果于2021年9月23日在线发表在Cell期刊上,论文标题为“ERα is an RNA-binding protein sustaining tumor cell survival and drug resistance”。

人乳腺癌细胞的三维培养物,DNA经染色后为蓝色,细胞表面膜蛋白经染色后为绿色。图片来自NIH。
在细胞核中,ERα调节DNA向信使RNA(mRNA)的转化,这一过程被称为转录。一旦形成,mRNA链从细胞核进入细胞质,在那里它指示核糖体制造蛋白质,这一过程被称为翻译。令人惊讶的是,这些作者发现ERα通过与新形成的mRNA结合在这个过程中也发挥了作用。论文第一作者、加州大学旧金山分校泌尿外科博士后Yichen Xu博士说,“到目前为止,雌激素受体结合RNA的功能一直隐藏在其作为转录因子的既定角色背后,它可能一直在暗地里地支持癌症的产生。”
6.Cell:免疫分子CD28缺失可能解释了为何一些HPV感染者会长出角状肿瘤
doi:10.1016/j.cell.2021.06.004
大多数人在他们生命中的某个时刻感染了人类乳头瘤病毒(HPV),但由于有强大的免疫反应,他们对此毫不知情。除非从他们的皮肤上长出巨大的角状生长物。HPV的一个极其罕见的特征被称为树人综合征(tree-man syndrome),这种特征与通常伴随着有症状的疾病的皮肤和生殖器疣有很大的差异。
为什么一种病毒能在少数人身上引起如此严重的反应,而让大多数人没有症状呢?在一项新的研究中,美国洛克菲勒大学的Jean-Laurent Casanova及其研究团队通过研究一名原本健康的患者的遗传学特性来回答这个问题,这名患者因感染一种称为HPV-2的HPV亚型而患上了严重的树人综合症,而他的两名个家庭成员因感染HPV-4而患有异常严重的疣。这名患者长出巨大的角状生长物。这种巨大的角状生长物形成了由HPV-2驱动的多灶性良性上皮肿瘤,该上皮肿瘤在表皮基底层过度表达病毒致癌基因。相关研究结果近期发表在Cell期刊上,论文标题为“Humans with inherited T cell CD28 deficiency are susceptible to skin papillomaviruses but are otherwise healthy”。
Casanova团队发现了一种突变,它通过减少CD28的产生来影响人体对HPV的反应,其中CD28是免疫系统中的一种蛋白分子,在激活对这种抗病原体的T细胞方面起着重要作用。除了只有一小部分回复变异型记忆CD4+T细胞除外,这名患者的T细胞表面上没有可检测到的CD28。T细胞的发育几乎不受影响,而且T细胞对CD3和CD2有反应,但对CD28的刺激没有反应。虽然这名患者在体外不显示HPV-2和HPV-4反应性CD4+T细胞,但他们在体内会产生对这两种HPV病毒的特异性抗体。CD28缺陷的小鼠对小鼠乳头瘤病毒MmuPV1的皮肤感染很敏感。角质细胞中对HPV-2和HPV-4的控制依赖于T细胞CD28共激活途径。
7.Cell:开发出一种新的基因递送载体---MyoAAV,有潜力使基因疗法更安全和更有效地肌肉疾病
doi:10.1016/j.cell.2021.08.028
遗传性肌肉疾病导致渐进性肌肉萎缩,经常导致早期死亡,治疗选择很少,也无法治愈。一些基因疗法使用无害的病毒载体将致病基因的功能性拷贝递送给细胞,在临床试验中显示出对一部分肌肉营养不良症的治疗前景,但也面临挑战。携带功能性基因拷贝的病毒载体需要高剂量才能到达整个身体的肌肉,而这些临床试验中使用的病毒载体往往最终地更多地进入肝脏而不是肌肉。这导致肝脏中的病毒载体含量过高,出现严重的不良副作用,甚至导致一些临床试验参与者的死亡。
在一项新的研究中,来自美国布罗德研究所和哈佛大学等研究机构的研究人员开发出一个新的腺相关病毒(AAV)家族---基因治疗中的基因递送主力,它们改善了对肌肉组织的靶向性,这对肌肉疾病患者可能更安全、更有效。这组病毒载体(他们称之为MyoAAV)到达肌肉的效率比目前临床试验中使用的病毒载体高10倍以上,并且在很大程度上避开了肝脏。他们发现,由于这种效率的提高,MyoAAV可用于递送治疗性基因,其剂量比其他研究和临床试验中使用的病毒载体低约100至250倍,有可能减少肝脏损伤和其他严重副作用的风险。相关研究结果于2021年9月9日在线发表在Cell期刊上,论文标题为“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”。论文通讯作者为哈佛大学教授、布罗德研究所成员Pardis C. Sabeti、Sabeti实验室的Mohammadsharif Tabebordbar和哈佛大学干细胞与再生生物学系教授Amy Wagers。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.028。
利用MyoAAV,这些作者将治疗性基因或CRISPR-Cas9基因编辑系统专门递送给肌肉细胞。他们改善了杜兴氏肌营养不良症小鼠模型和X连锁肌管性肌病小鼠模型的肌肉功能,其中杜兴氏肌营养不良症是最常见的遗传性肌肉疾病,而X连锁肌管性肌病是一种更罕见的遗传性肌肉疾病。他们还发现,MyoAAV可以有效地将基因疗法传递给非人类灵长类动物的肌肉和人类肌肉细胞。
8.Cell:实体瘤治疗重大进展!递送内源性RNA的CAR-T细胞可改善对实体瘤的治疗
doi:10.1016/j.cell.2021.08.004
嵌合抗原受体(CAR)T细胞(CAR-T)疗法利用经过基因改造的T细胞来治疗某些类型的癌症,但是由于较差的肿瘤浸润、功能衰竭和抗原匮乏,CAR-T细胞在治疗实体瘤时经常遭遇挑战,它们的疗效受到限制。CAR-T细胞需要识别癌细胞上的特定靶标来杀死它们。然而,癌细胞并不总是携带特异性的靶标,或者它们找到了隐藏靶标的方法,从而免受CAR-T细胞的攻击。递送模式识别受体激动剂是提高免疫功能的一种策略,然而,将这些激动剂靶向到免疫细胞是具有挑战性的,而且在癌细胞中脱靶信号可能是有害的。
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现作为一种自然发生的激活RIG-I/MDA5信号的内源性RNA,RN7SL1可以激活身体自身的天然T细胞,以寻找逃避CAR-T细胞识别的癌细胞。这可能有助于改善治疗实体瘤的努力,毕竟实体瘤占人类癌症的大多数。相关研究结果于2021年8月30日在线发表在Cell期刊上,论文标题为“The immunostimulatory RNA RN7SL1 enables CAR-T cells to enhance autonomous and endogenous immune function”。
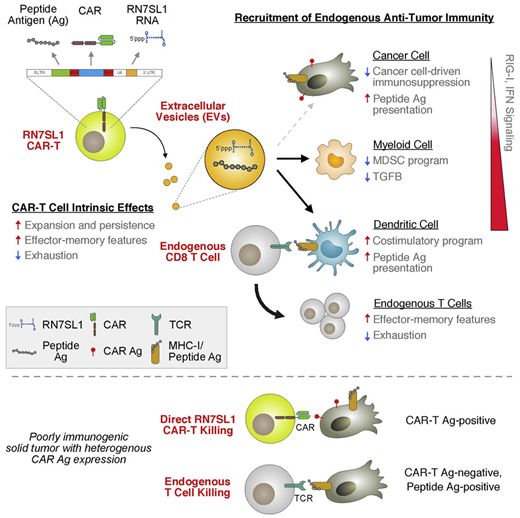
图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.004。
第一种工具是一种称为RN7SL1的内源性RNA。当由CAR-T细胞递送给肿瘤时,RN7SL1模拟了病毒RNA。RN7SL1被部署在CAR-T细胞释放的胞外囊泡中并选择性地转移到先天免疫细胞中,并激活RIG-I/MDA5信号。就像病毒感染后,作为身体免疫系统的一个分支,先天免疫细胞在看到CAR-T细胞递送的RN7SL1后被激活。这些先天免疫细胞如今可以刺激身体的T细胞,动员它们加入对癌症的攻击。然而,与CAR-T细胞一样,身体的天然T细胞也需要在癌细胞上找到一种靶标来识别和攻击。因此,CAR-T细胞提供的第二种工具是外来抗原,这些外来抗原被“涂抹”在癌细胞的表面,本质上标志着它们被天然的T细胞杀死。
这些作者利用小鼠模型表明,用这种一箭双雕的方式武装CAR-T细胞,招募身体自身的免疫系统,可以防止肿瘤复发,即使许多癌细胞不能被单独的CAR-T细胞识别和杀死。因此,对 CAR-T细胞进行基因改造,使之递送RN7SL1和外来抗原,可能有助于打击实体瘤逃避CAR-T细胞的常见方式,从而增强疗效。
9.Cell:特殊免疫细胞ILC3s或能维持免疫系统和肠道微生物之间的“健康对话” 从而保护机体抵御结直肠癌发生
doi:10.1016/j.cell.2021.07.029
结直肠癌是美国第四大最常见的癌症类型,每年大约有15万人被确诊,而且约有5万人会死于该病。尽管结肠镜筛查早期发下你这些癌症或癌前息肉非常有效,但晚期结直肠癌因治疗方法非常有限,对于患者和临床医生而言仍然是一大挑战;肿瘤学家非常关注这些肿瘤对免疫疗法产生的相对耐受性,这些疗法能通过增强宿主机体的免疫系统功能来攻击恶性细胞,从而就有望抵御其它癌症。
第三组先天性淋巴细胞(ILC3s,Group 3 innate lymphoid cells)能调节机体的免疫力和炎症,然而其在癌症发生过程中所扮演的关键角色研究人员却并不清楚;近日,一篇发表在国际杂志Cell上题为“Dysregulation of ILC3s unleashes progression and immunotherapy resistance in colon cancer”的研究报告中,来自康奈尔大学等机构的科学家们通过研究发现,ILC3s或能保护宿主机体抵御结直肠癌,其中部分原因是ILC3s能帮助维持机体免疫系统和肠道微生物之间的“健康对话”。
这篇研究结果表明,ILC3s在结直肠癌患者中往往会急剧减少并发生功能性改变,此外,通过实验性地破坏小鼠机体中ILC3s的功能或会导致侵袭性结肠癌的发生,并能明显降低癌症免疫疗法的效率。研究者Gregory Sonnenberg说道,本文研究为结直肠癌的临床治疗提出了新的可能性,也有助于帮助解释为何这类癌症往往不会对免疫疗法产生反应。
10.Cell:发现隐藏在结直肠肿瘤中的免疫细胞“中枢”
doi:10.1016/j.cell.2021.08.003
人体内的肿瘤就像一座战争中的城市,充斥着癌细胞、免疫细胞、血管、信号分子和周围组织。对这些参与者的简单普查将提供一些关于它们之间发生战斗的基本信息,但不会揭示它们在战斗中采取的战略或空间排列。在一项新的研究中,来自美国布罗德研究员、麻省理工学院、哈佛医学院和布莱根妇女医院的研究人员对采取的这种空间排列有了新的认识。他们发现,一些人类结直肠肿瘤中的免疫细胞聚集在一起,就像士兵在编队时的动员。通过使用单细胞分析和成像技术的独特组合,以及新开发的数据分析方法,他们发现了以前在肿瘤中没有观察到的细胞空间排列水平。相关研究结果发表在2021年9月2日的Cell期刊上,论文标题为“Spatially organized multicellular immune hubs in human colorectal cancer”。
这些研究结果指出在某些类型的结直肠肿瘤中,相互作用的免疫细胞网络(或者说中枢)往往更容易被免疫系统“看到”。这表明含有这种免疫细胞网络的结肠癌可能更有可能对刺激免疫系统杀死癌细胞的抗癌药物(称为免疫疗法)产生反应。这项研究可能阐明了如何使其他肿瘤对这类治疗更有反应。
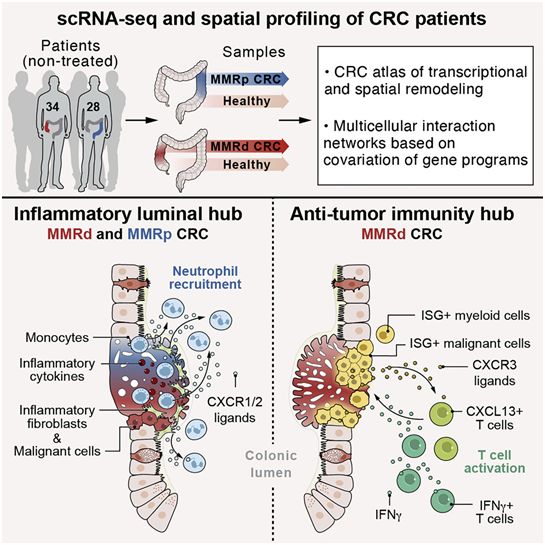
图片来自Cell, 2021, doi:10.1016/j.cell.2021.08.003。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


