重要研究成果聚焦科学家们在衰老研究领域取得的新进展!
来源:本站原创 2021-09-27 10:38
如何预防减缓衰老是科学家们所面临的诸多挑战之一,近年来他们投入了大量精力和资金进行人类衰老研究,本文中,小编整理了多篇研究成果共同解读科学家们在衰老研究领域取得的重要研究成果,分享给大家!【1】Science子刊:新研究表明表达NANOG可逆转骨骼肌衰老doi:10.1126/sciadv.abe5671在一项新的研究中,来自美国布法罗大学的研究人员发现一种
如何预防减缓衰老是科学家们所面临的诸多挑战之一,近年来他们投入了大量精力和资金进行人类衰老研究,本文中,小编整理了多篇研究成果共同解读科学家们在衰老研究领域取得的重要研究成果,分享给大家!

复制性衰老后人成肌细胞中的NANOG过度表达。
图片来源:Science Advances, 2021, doi:10.1126/sciadv.abe5671。
【1】Science子刊:新研究表明表达NANOG可逆转骨骼肌衰老
doi:10.1126/sciadv.abe5671
在一项新的研究中,来自美国布法罗大学的研究人员发现一种称为NANOG的转录因子能够有小弟逆转骨骼肌细胞的衰老。相关研究结果发表在2021年9月3日的Science Advances期刊上,论文标题为“Ameliorating the hallmarks of cellular senescence in skeletal muscle myogenic progenitors in vitro and in vivo”。
在一系列的实验中,这些作者在称为成肌细胞(myoblast)的肌源性祖细胞(myogenic progenitor)中过度表达NANOG。成肌细胞处于衰老状态会阻碍骨骼肌再生,这意味着它们不再能够分裂和生长。
在衰老的成肌细胞中过量表达转录因子NANOG可以克服细胞衰老的影响,并赋予衰老细胞以年轻的表型。NANOG过度表达改善了与年龄相关的细胞衰老的一些主要特征,包括不活跃的自噬、蛋白稳态丧失、基因组不稳定、细胞核完整性受到破坏和线粒体功能障碍。NANOG的恢复青春作用包括通过上调DNA修复蛋白来恢复DNA损伤反应,通过组蛋白上调来恢复异染色质标记,以及通过上调AMP激活蛋白激酶(AMPK)来重新激活自噬和线粒体能量。
【2】Nat Aging:乙酸盐可让衰老的间充质干细胞恢复青春
doi:10.1038/s43587-021-00105-8
随着年龄的增长,我们的骨骼变得越来越薄,我们更频繁地遭受骨折,骨质疏松症等骨骼疾病也更容易发生。一种相关的机制涉及维持骨骼完整性所必需的间充质干细胞(mesenchymal stem cell, MSC)的功能受损。如今,在一项新的研究中,来自德国马克斯-普朗克老化生物学研究所和科隆大学的研究人员发现衰老后的间充质干细胞功能的降低是由于其表观基因组的变化。他们能够通过添加乙酸盐来逆转分离的间充质干细胞发生这些变化。这种表观基因组的青春之泉可能成为治疗骨质疏松症等骨骼疾病的重要手段。相关研究结果发表在2021年9月的Nature Aging期刊上,论文标题为“Chromatin remodeling due to degradation of citrate carrier impairs osteogenesis of aged mesenchymal stem cells”。
研究衰老的科学家们将表观遗传学作为衰老过程的原因已经有一段时间了。表观遗传学研究遗传信息和染色体的变化,这些变化不改变基因本身的序列,但确实影响其活性。一种可能性是在我们的细胞中包装DNA从而控制对DNA的访问的组蛋白发生变化。论文通讯作者、马克斯-普朗克老化生物学研究所的Peter Tessarz及其团队如今研究了间充质干细胞的表观基因组。这些干细胞存在于骨髓中,可以产生不同类型的细胞,如软骨细胞、骨细胞和脂肪细胞。
研究者Andromachi Pouikli解释道,“我们想知道为什么随着年龄的增长,这些干细胞产生的用于骨骼发育和维护的物质越来越少,导致越来越多的脂肪在骨髓中堆积。为了做到这一点,我们比较了年轻和年老小鼠间充质干细胞的表观基因组。我们可以看到,这些干细胞的表观基因组随着年龄的增长而发生明显变化。对骨骼生产有重要作用的基因尤其受到影响。”
【3】PNAS:揭示一种非编码RNA在机体衰老和癌症发生过程中所发挥的新功能
doi:10.1073/pnas.2025647118
在机体衰老过程中,衰老细胞会分泌炎性因子,并引发多种年龄相关的病症;因此,控制衰老相关的分泌表型(SASP,senescence-associated secretory phenotype)或能极大有益于人类机体健康,尽管SASP似乎是由染色体组织的改变所诱导的,但其背后的分子机制研究人员并不清楚。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Pericentromeric noncoding RNA changes DNA binding of CTCF and inflammatory gene expression in senescence and cancer”的研究报告中,来自日本癌症研究基金会癌症研究所等机构的科学家们通过研究发现,源自中心体周围重复序列(pericentromeric repetitive sequences)的非编码RNA在机体衰老和癌症发生过程中或能促进炎性基因的表达。
衰老是一种基本不可逆的细胞周期停滞状态,主要由多种压力因素所诱发,包括衰老、肥胖、辐射和化疗等,在衰老过程中在体内积累的衰老细胞能与通过产生促炎性蛋白与周围组织交流沟通,这种促炎性蛋白称之为衰老相关的分泌表型(SASP),其在机体多种生理学和病理学过程中扮演着关键角色;在衰老个体中,炎性SASP因子能促进多种年龄相关疾病的发生,包括癌症等,因此,清除SASP的调节性机制对于开发新型预防和治疗性策略来抵御年龄相关的癌症至关重要。
研究人员推测,在衰老细胞中所观察的异常染色质架构或许与SASP相关,同时利用新一代的测序技术就能开始分析全基因组染色质相互作用和基因表达的特征。研究者发现了含有称之为人类卫星II(hSATII)的中心体周围重复序列的区域,其在正常细胞中是表观遗传沉默状态的,但在衰老细胞中则会表现出明显的开放状态;此外,非编码RNA—hSATII RNA的表达在细胞衰老过程中也会明显上调。进一步分析后,研究者发现,hSATII RNA能通过对CCCTC结合因子(CTCF)的功能损伤来然乱某些SASP基因区域中的染色质互作,从而就能上调SASP样炎性基因的表达,CTCF对于基因组完整性的维持至关重要。
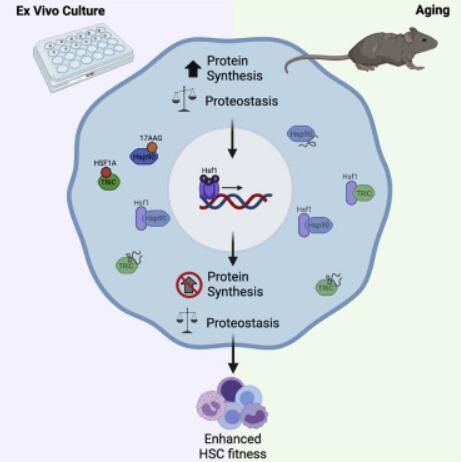
图片来源:Cell Stem Cell, 2021, doi:10.1016/j.stem.2021.07.009。
【4】Cell Stem Cell:蛋白HSF1促进造血干细胞在外培养时保持健康和对抗衰老
doi:10.1016/j.stem.2021.07.009
作为血细胞的前体细胞,造血干细胞(HSC)一直是出了名的难以在培养皿中生长。在一项新的研究中,来自美国加州大学圣地亚哥分校和拉霍亚免疫学研究所的研究人员发现了这个潜在的问题为何产生,并开发出一种方法来让体外培养的造血干细胞保持健康。这些发现对寻求造血干细胞移植的患者来说是个好消息,并可能指出了一种抵御造血干细胞衰老的新方法。相关研究结果于2021年8月12日在线发表在Cell Stem Cell期刊上,论文标题为“Hsf1 promotes hematopoietic stem cell fitness and proteostasis in response to ex vivo culture stress and aging”。
在骨髓移植中,造血干细胞被静脉输注,以重建骨髓或免疫系统受损的患者体内的血液生产。该方法用于治疗白血病、淋巴瘤、再生障碍性贫血和免疫缺陷疾病等疾病。然而,需要造血干细胞输注的患者并不总是能得到他人捐赠的造血干细胞。
研究者Robert Signer博士说,“即使是接受造血干细胞治疗的患者,移植更多的细胞也会产生更少的并发症,并增加总体上的成功机会。”当科学家们试图通过在培养皿中重现骨髓环境来培养造血干细胞时,Signer及其团队问道,是什么内部机制使这些干细胞开始变得不健康,他们能否直接补救这一过程?
在这项新的研究中,论文第一作者、Signer实验室博士后研究员Miriama Kruta博士及其同事们发现在培养皿的外来环境中,造血干细胞开始产生过量的蛋白质,造成极端应激。这种应激状态激活了热休克反应,即一种是由热休克因子1(HSF1)调节的高度保守的应激减少途径。这些作者确定了两种不同的小分子:Hsp90抑制剂坦螺旋霉素(tanespimycin, 全称17-N-allylamino-17-demethoxygeldanamycin,缩写17-AAG)和HSF1激活剂(HSF1 activator, HSF1A),它们都能高度激活HSF1基因。通过向体外培养的造血干细胞中添加这两种小分子中的一种,热休克途径的活性增强有助于重新平衡造血干细胞的平衡状态或者稳态。
【5】Nature:揭示衰老的骨骼干细胞干扰骨折愈合并促进炎性衰老
doi:10.1038/s41586-021-03795-7
在一项新的研究中,来自美国斯坦福大学的研究人员发现衰老的骨骼干细胞(skeletal stem cell, SSC)的变化可能是导致骨折愈合不良、骨质疏松症、各种血液疾病的根本原因,以及以及全身细胞和系统的普遍炎症和衰老---有时称为“炎性衰老(inflamm-aging)”---的根本原因。不过,他们还发现他们如何使衰老的骨骼干细胞重新焕发活力,使它们重新变得年轻,从而有可能逆转这些变化。相关研究结果于2021年8月11日在线发表在Nature期刊上,论文标题为“Aged skeletal stem cells generate an inflammatory degenerative niche”。
Chan博士说,“骨骼干细胞产生骨细胞、软骨细胞和为造血干/祖细胞(haematopoietic stem and progenitor cell, HSPC)发育提供了微环境或温床的基质细胞谱系。因此,如果衰老的骨骼干细胞表现不佳,它们会导致我们在老年人身上发现的各种各样的疾病。”
这些作者首先被衰老的骨骼干细胞如何导致老年人骨折愈合问题所吸引。骨骼愈合困难是导致老年人发病和死亡的主要原因之一。Chan和Longaker在之前的首次发现和表征了骨骼干细胞的研究工作基础上,研究了骨骼干细胞的行为如何随着年龄增长而改变。他们发现,与年轻小鼠相比,年老小鼠的骨骼干细胞的活性要低很多。Chan说,“当骨骼愈合时,它在骨折处形成骨痂(callus),其中通常充满了骨骼干细胞。但是在年老小鼠中,愈合部位的骨骼干细胞要少得多。”他们发现,与年轻的骨骼干细胞相比,衰老的骨骼干细胞在实验室培养皿中形成集落或骨骼的能力也较差。
正常情况下,骨骼是不断变化的,旧的骨组织被吸收,新的骨被补充来代替它,从而修复随着时间的推移出现的微小骨折。在年轻、健康的骨骼中,这一过程是平衡的。但在年老的骨骼中,这些作者发现,衰老的骨骼干细胞所表达的基因与骨形成减少和骨吸收(bone resorption)增加有关。这种骨形成和骨吸收之间的不平衡最终导致了骨质疏松症。
【6】Science:对抗与年龄相关的VEGF信号不足可促进健康衰老和延长寿命
doi:10.1126/science.abc8479
所有的体细胞都依赖血管来提供氧气和其他血液携带的物质,在某些情况下,还依赖血管内皮衍生的旁分泌因子。与其他器官系统一样,血管系统也会经历衰老,从而导致功能逐渐退化。鉴于血管对器官稳态的核心作用,有人假设血管衰老是机体衰老的上游的起始因素,但对这一主张的实验支持是有限的。血管衰老涉及大血管和小血管,后者的特点是毛细血管稀少,即与年龄有关的不能保持足够的微血管密度(microvascular density, MVD)。防止MVD减少的一个关键稳态机制依赖于血管内皮生长因子(VEGF)的血管生成活性,由于其缺氧诱导性,它不断地补充失去的血管并使血管供应与组织需求相匹配。VEGF在衰老过程中不能这样做到这一点的原因尚不清楚。
血管功能受损预计会扰乱器官稳态,从而促进年龄相关性的虚弱和疾病产生。因此,抵制血管衰老的关键方面可能是缓解这些症状的有效方法。假设衰老中的血管供应不足是由VEGF信号不足引起的,主要是(但不完全是)因为它在防止毛细血管损失方面起着不可或缺的作用,这促使以色列研究人员在一项新的研究中探究了确保VEGF信号维持在年轻时的水平是否能校正毛细血管损失及其后遗症。在血管功能恶化是多器官功能障碍的上游驱动因素的前提下,他们设想这种校正可能提供全面的老年保护。相关研究结果发表在2021年7月30日的Science期刊上,论文标题为“Counteracting age-related VEGF signaling insufficiency promotes healthy aging and extends life span”。
尽管在小鼠衰老过程中,VEGF的产生没有明显减少,但纵向监测显示,VEGF在多个关键器官中的信号传递大大减少。这与可溶性VEGFR1(sVEGFR1)产生的增加有关,这是通过VEGFR1 mRNA的选择性剪接及其捕获VEGF的活性的年龄相关变化产生的。通过使用转基因VEGF功能获得系统或腺相关病毒(AAV)辅助的VEGF转导,适度增加循环的VEGF,可以保持更年轻的VEGF信号水平,并提供保护以防止与年龄有关的毛细血管损失、损害灌注和下降的组织氧合。衰老的标志,如线粒体功能障碍、代谢灵活性受损、内皮细胞衰老和炎症反应,在经VEGF处理的小鼠中得到缓解。
【7】Nature:暴露在污染物中,增加的自由基损伤会加速衰老
doi:10.1038/s41586-021-03547-7
每天,我们的身体都面临着紫外线、臭氧、香烟烟雾、工业化学品和其他危害的轰击。这种暴露可能导致我们体内自由基的产生,从而损害我们的DNA和组织。在一项新的研究中,来自美国西弗吉尼亚大学和明尼苏达大学的研究人员发现未修复的DNA损伤会增加衰老的速度。相关研究结果近期发表在Nature期刊上,论文标题为“An aged immune system drives senescence and ageing of solid organs”。
这些作者培育出经过基因改造的小鼠(下称基因改造小鼠),从而使得它们的造血干细胞(发育成白细胞的未成熟免疫细胞)中缺少一种关键的DNA修复蛋白。没有这种修复蛋白,小鼠就无法修复其免疫细胞中累积的受损DNA。当一只基因改造小鼠5个月大时,它就像一只2岁的小鼠。它有后者的所有症状和身体特征。它有听力损失、骨质疏松症、肾功能障碍、视觉障碍、高血压以及其他与年龄有关的问题。它过早衰老只是因为它已经失去了修复DNA的能力。根据这些作者的说法,一只正常的2岁小鼠在年龄上大约相当于70岁到80岁出头的人类。这些作者发现,与正常的野生型小鼠相比,细胞老化或衰老的标志物,以及细胞损伤和氧化的标志物,在基因改造小鼠的免疫细胞中明显增多。但这种损害并不局限于免疫系统;基因改造小鼠在肝脏和肾脏等器官中也表现出老化、受损的细胞。这些结果表明,未修复的DNA损伤可能导致整个身体过早衰老。
当我们暴露在污染物中时,例如用于癌症治疗的放疗,能量就会转移到我们体内的水中,将水分解。这就产生了高度反应性的分子---自由基,它们会迅速与另一个分子相互作用,以获得电子。当这些自由基与重要的生物大分子(如蛋白质或DNA)相互作用时,会造成损害,使这些生物大分子无法正常工作。
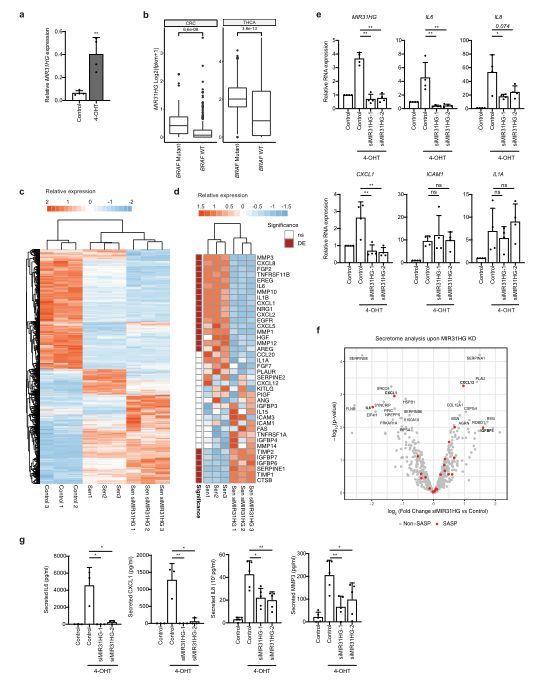
MIR31HG基因敲除降低BRAF诱导衰老过程中SASP组分的诱导
图片来源:https://doi.org/10.1038/s41467-021-22746-4
【8】Nature子刊:长非编码RNA MIR31HG调控衰老相关的分泌表型
doi:10.1038/s41467-021-22746-4
来自哥本哈根大学研究者在NATURE COMMUNICATIONS杂志上发表了题为"The long non-coding RNA MIR31HG regulates the senescence associated secretory phenotype"的文章。该研究表明了,MIR31HG在衰老过程中具有双重作用,这取决于它的定位,并表明lncRNA在治疗衰老相关疾病方面具有潜在的治疗靶点。
细胞衰老是一种不可逆转的生长停滞状态,可由多种刺激因素引起,包括由于广泛复制、dna损伤、氧化应激或癌基因过度表达而导致的端粒缩短。此外,最近研究表明,衰老可以在分化和组织再生中发挥作用。癌基因诱导衰老(OIS)最早是由Serrano等人报道的,当时他们观察到在原代成纤维细胞中表达一种致癌形式的RAS可以诱导衰老。后来的工作表明,其他癌基因,如突变的braf,在体内和体外都促进了ois。OIS一直被认为是阻止肿瘤进展的屏障,需要肿瘤抑制基因的额外突变才能绕过衰老促进恶性肿瘤。衰老细胞表现出特征性的形态和生化特征,如增殖停止,体积增大,衰老相关的β半乳糖苷酶激活,细胞周期抑制因子的表达,以及衰老相关的异染色质灶的存在。重要的是,在几种类型的衰老中,细胞分泌白细胞介素、细胞因子和金属蛋白酶等因子,这些因子是衰老相关分泌表型(SASP)的一部分,可以影响细胞环境和邻近组织的稳态。SASP的下游效应可能是有益的,也可能是有害的,具体取决于组织环境。它已被证明通过增强自分泌衰老、诱导邻近细胞旁分泌衰老以及通过诱导组织修复和再生来防止癌症进展。
SASP还可以激活免疫系统,促进受损细胞的清除。另一方面,SASP可以促进肿瘤的形成过程,如血管生成和侵袭。在衰老过程中,过多的SASP分泌会引起慢性炎症,从而导致衰老相关的病理改变。SASP的组成随着衰老刺激和细胞类型等不同方面的不同而变化很大。确定分泌体的组成并在每种生物背景下鉴定新的调节子对于鉴定这种复杂表型的分子特征至关重要。
【9】Nature:年轻的免疫细胞可以逆转衰老,研究发现抗衰老药物重要靶点
doi:10.1038/s41586-021-03547-7
衰老是一种细胞周期停滞的状态,在胚胎发生、伤口愈合和预防癌症中起着重要作用。衰老的关键驱动因素为衰老细胞(senescent cell)。衰老细胞具有“促生存网络” ,可以抵抗细胞凋亡或程序性细胞死亡,因此会随着机体衰老而累积。它们释放一系列促凋亡、促炎、导致干细胞功能紊乱、破坏组织、向正常细胞扩散衰老、衰老相关分泌表型(SASP)的因素。这导致了与年龄相关的疾病和慢性疾病的发生,如动脉粥样硬化、2型糖尿病、关节炎、特发性肺纤维化和肝病。
在衰老的过程中,免疫系统会失去对抗病原体和癌细胞的有效反应能力,即免疫衰老。其特征为未致敏T细胞: 记忆T细胞比率、CD4:CD8比率、钙介导信号受损和胸腺萎缩等。这些变化限制了接种疫苗的有效性,增加了疾病易感性,并导致老年人死亡。然而,对于老年免疫系统如何导致免疫衰老这个问题,科学界却知之甚少。2021年5月12日,美国明尼苏达大学的两位教授Paul Robbins和Laura Niedernhofer联合通信,于 Nature在线发布了名为 “An Aged Immune System Drives Senescence and Ageing of Solid Organs” 的研究论文,结果表明衰老的免疫细胞会导致全身组织损伤,缩短寿命。
这项研究的主要结论是内源性DNA损伤容易影响免疫细胞,若不修复,就会导致细胞死亡或衰老,因此衰老的免疫细胞也成为延长健康寿命的关键治疗靶标。与正常衰老一样,实验室中的衰老损害先天免疫和适应性免疫——特别损害滤泡辅助性T细胞和自然杀伤细胞的功能,并潜在地驱动身体器官的衰老。实质损伤的机制似乎是细胞自主性(功能丧失)和细胞非自主性(功能获得,如SASP)的结合。研究人员总结,利用抗衰老药物靶向治疗衰老免疫细胞,在抑制多种老年疾病方面十分具有潜力。
【10】Science:首个临床实验表明抗衰老化合物NMN可改善人体骨骼肌中的葡萄糖代谢
doi:10.1126/science.abe9985
一种称为烟酰胺单核苷酸(nicotinamide mononucleotide, NMN)的天然化合物在啮齿类动物中的显著有益效果已导致日本、中国和美国的几家公司将这种化合物作为膳食补充剂或保健品销售。美国食品药品管理局(FDA)并未授权在膳食补充剂产品上市前对其安全性和有效性进行审查,尽管缺乏证据表明NMN对人体有临床益处,但美国和世界各地的许多人现在都在服用NMN。
在一项新的双盲临床研究(ClinicalTrial.gov NCT 03151239)中,来自美国华盛顿大学圣路易斯医学院的研究人员发现以前被证实在小鼠中可以对抗衰老和改善代谢健康的NMN对人类代谢功能有临床相关的影响。这项研究是首个探究NMN给送在人体内的代谢效果的双盲随机临床试验。相关研究结果于2021年4月22日在线发表在Science期刊上,论文标题为“Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women”。
这项针对绝经后糖尿病前期(prediabetes,也译为前驱糖尿病)女性的小型临床试验显示,胰岛素刺激的葡萄糖清除(可通过高胰岛素-正糖钳夹技术进行评估),以及骨骼肌的胰岛素信号(AKT和mTOR的磷酸化)在NMN补充后有所增加,但在安慰剂治疗后没有变化,这意味着化合物NMN改善了胰岛素增加骨骼肌摄取葡萄糖的能力,这种能力在肥胖、糖尿病前期或2型糖尿病患者中往往是不正常的。NMN还上调了血小板源性生长因子受体β和其他与肌肉重塑有关的基因的表达。然而,这种治疗并没有降低血糖或血压、改善血脂状况、增加肝脏中的胰岛素敏感性、减少肝脏中的脂肪或减少小鼠体内的炎症循环标志物。在参与这项临床研究的女性中,13人每天口服250毫克NMN,持续10周,12人在相同时间内每天服用无药效的安慰剂。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


