Chemical Engineering Journal:报道华东理工大学在酶工程方向研究成果
来源:华东理工大学 2021-09-08 08:28
近日, 华东理工大学生物反应器工程国家重点实验室李志敏教授课题组在酶工程方向取得新进展,有关成果在Chemical Engineering Journal以“Iterativeconformational dynamics-guided protein engineering reshapes biocatalystpropertie
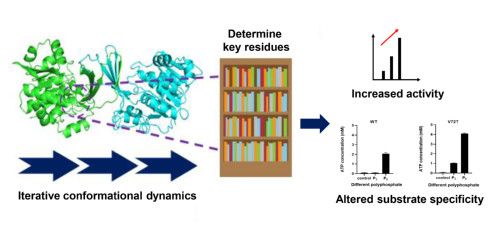
近日, 华东理工大学生物反应器工程国家重点实验室李志敏教授课题组在酶工程方向取得新进展,有关成果在Chemical Engineering Journal以“Iterativeconformational dynamics-guided protein engineering reshapes biocatalystproperties for efficient and cost-effective cytidine 5'-monophosphateproduction” 为题进行了报道。
基于分子-构象动力学模拟的虚拟筛选结合湿法实验是获得目标蛋白质的一种有吸引力的方法。然而,传统的构象动力学可能无法最大程度地筛选影响酶性能的关键残基,导致蛋白质改造成功率低。为了获得尽可能多且可靠性高的关键残基,作者提出了一种迭代构象动力学分析(ICDA)策略。ICDA不仅考虑温度对蛋白整体的影响,而且还结合残基之间相互作用,可提高突变文库质量。
作者前期构建了嗜极酶耦联生产胞苷酸体系(Li et al. J. Agr. FoodChem. 2020),基于该体系验证了ICDA方法。通过多代丙氨酸扫描和动力学模拟,快速确定了体系中胞苷激酶的24个核心残基。在模拟结果的指导下,进一步选择了5个残基进行深入分析,得到2个关键残基(A220和A248)和15个突变,并通过实验和计算评估所有突变体。其中A220L变体催化底物胞苷的活性增加了7.3倍,A248S的kcat/Km增加了3.5倍。两个变体均可替换野生型胞苷激酶,通过嗜极酶耦联体系在5小时内将400 mM胞苷完全转化为胞苷酸,平均生产速率较原始水平提高了4倍。
为了证明ICDA的普遍适用性,作者还研究了耦联体系中的多聚磷酸激酶,通过对多聚磷酸激酶执行ICDA分析,快速确定了17个关键残基,并选择其中三个残基(E40、V72和A98)进行饱和突变,得到57个突变体。选择10个均方根波动发生显着变化的多聚磷酸激酶突变体用于全细胞催化实验。结果表明,V72T变体可催化三聚磷酸盐和ADP生成ATP的反应。使用多聚磷酸激酶变体与胞苷激酶变体耦联,不仅提高了胞苷酸的生产效率,而且降低了成本。这些结果有力地支持了ICDA方法的适用性。相关研究结果均已申请专利(专利申请号202110403969.3和202110404992.4)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


