NAT IMMUNOL:胰岛素信号建立了脂肪调节性T细胞的发育轨迹
来源:生物谷 2021-09-28 13:36
具有调节表型的免疫细胞具有预防全身代谢紊乱的重要辅助功能,来自脂肪组织的调节性T细胞(Treg)能表达大量的过氧化物酶体增殖物激活受体-γ(PPAR-γ),从而在生理条件下抑制效应T(Teff)细胞和其他免疫细胞类型的活性,保持胰岛素敏感性,进而控制全身代谢稳态。
具有调节表型的免疫细胞具有预防全身代谢紊乱的重要辅助功能,来自脂肪组织的调节性T细胞(Treg)能表达大量的过氧化物酶体增殖物激活受体-γ(PPAR-γ),从而在生理条件下抑制效应T(Teff)细胞和其他免疫细胞类型的活性,保持胰岛素敏感性,进而控制全身代谢稳态。
研究表明,脂肪Treg细胞表达独特的T细胞抗原受体(TCR)库,TCR特异性可能通过干扰素调节因子4(IRF4)和基本亮氨酸拉链转录因子(BATF)驱动PPAR-γ表达,而其他研究进一步表明,脂肪Treg细胞的积累需要主要组织相容性复合体(MHC)II类分子、警报素细胞因子白细胞介素(IL)-33以及性激素和胰岛素信号呈递的抗原。此外,转录因子B淋巴细胞诱导成熟蛋白1(BLIMP1)能够激活IL-33受体ST2(即白细胞介素1受体样1,Il1rl1)的表达,因此促进IL-33介导的脂肪Treg细胞的扩增。
图片来源:https://doi.org/10.1038/s41590-021-01010-3
尽管以前的见解揭示了脂肪Treg细胞的胰岛素敏化作用,但它们在不同生理条件下的作用和预测潜力目前仍有争议。在肥胖脂肪中,脂肪Treg细胞抑制过度活跃的免疫反应并有助于保持胰岛素敏感性,然而在老化的脂肪中却发现增加脂肪Treg细胞的积累无法预防与年龄相关的胰岛素抵抗,基于这些发现,研究者认为脂肪Treg细胞能够分化成一系列状态并在体内发挥不同的生理影响,但驱动脂肪Treg细胞亚群之间状态转换的分子机制还不是很清楚。为了解决这个问题,该研究使用测序的转座酶可接近染色质的单细胞检测(scATAC-seq)、配对的单细胞RNA测序(scRNA-seq)和T细胞受体测序(TCR-seq),以揭示脂肪Treg细胞亚群的染色质景观、调节模块、克隆结构和表型,此外,还提出了一种新的机制模型,揭示了老年和肥胖环境中脂肪Treg细胞亚群的动态。
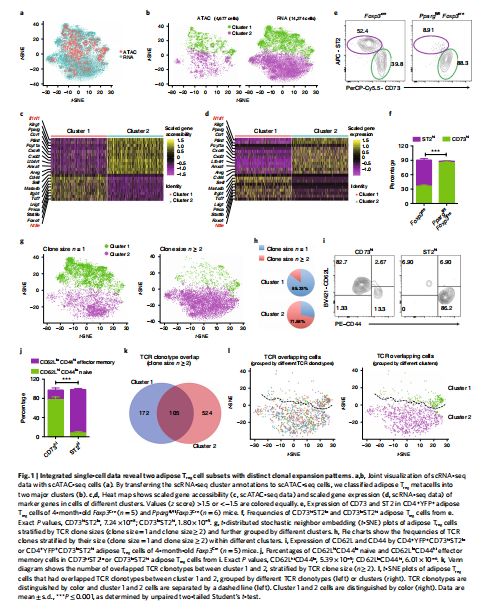
综合单细胞数据揭示了两种具有不同克隆扩增模式的脂肪Treg细胞亚群 图片来源:https://doi.org/10.1038/s41590-021-01010-3
为了研究脂肪Treg细胞少数离散状态的经典概念,研究者对来自小鼠脂肪的分选Treg细胞进行了scATAC-seq、配对scRNA-seq和TCR-seq,并利用基于液滴的微流体系统Chromium (10X Genomics)捕获单个细胞,过滤后,在scATAC-seq数据中获得了4677个优质细胞,在scRNA-seq数据中获得了14274个细胞。随后,用scATAC-seq锚定scRNA-seq实验以生成集成的单细胞数据,并在密切相关的脂肪Treg细胞亚群中探索独特的分子程序,两个数据集的联合可视化表明脂肪Treg元细胞的表型复杂性水平相似。因此,研究者进一步生成了关于脂肪Treg细胞染色质可及性和基因表达谱的资源,即通过将scRNA-seq簇转移到scATAC-seq细胞,从而将脂肪Treg元细胞分为具有明确定义的标记基因的两个主要簇。簇1 (CD73hiST2lo)脂肪Treg细胞表达淋巴组织相关标记,如转录因子7(Tcf7)、叉头框蛋白1(Foxo1)和亮氨酸丰富重复免疫球蛋白样域蛋白1(Lrig1),而簇2 (CD73loST2hi)对应物表达非淋巴组织相关基因,如Il1rl1、杀伤细胞凝集素样受体G1(Klrg1)、过氧化物酶体增生激活受体γ(Pparg)和双调蛋白(Areg),其中PPAR-γ是第2簇细胞中的关键转录因子,它的缺失消除了CD73loST2hi脂肪Treg细胞亚群在体内的生成。
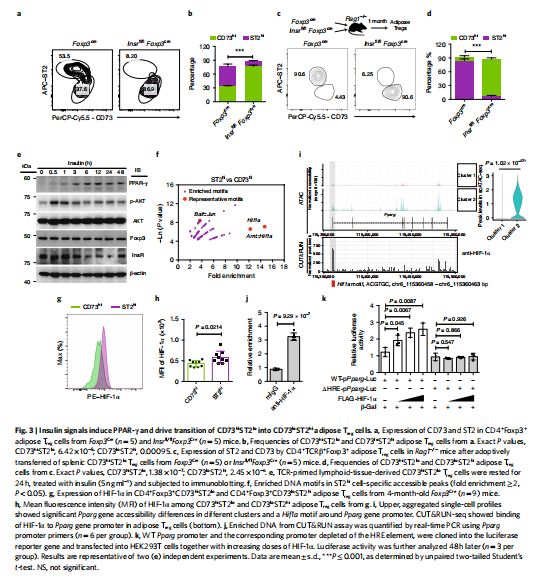
胰岛素信号诱导PPAR-γ并驱动CD73hiST2lo转变为CD73loST2hi脂肪Treg细胞 图片来源:https://doi.org/10.1038/s41590-021-01010-3
为了破译ST2hi脂肪Treg细胞生成是否需要胰岛素信号传导,研究者通过将Insrfl/fl小鼠与Foxp3Cre小鼠杂交,专门删除了Treg细胞中的胰岛素受体(Insr),因为InsR的缺失抑制了ST2hi 脂肪Treg细胞的产生。为了进一步研究CD73hiST2lo和CD73loST2hiTreg细胞之间的前体-后体关系,对野生型(WT)或InsR缺陷的脾CD73hiTreg细胞进行了分类并将它们转移到Rag1-/-小鼠中,进而证明了CD73hiTreg细胞在体内分化为ST2hi脂肪Treg细胞,而InsR的缺失破坏了这种转化。这些结果表明InsR是CD73hi在体内转化为ST2hi脂肪Treg细胞所必需的。
胰岛素信号通过缺氧诱导因子-1α和转录中介体复合物23(HIF-1α-Med23)产生以诱导PPAR-γ表达 图片来源:https://doi.org/10.1038/s41590-021-01010-3
为了剖析HIF-1α在PPAR-γ表达中的作用,TCR引发的淋巴组织衍生的CD73hiST2loTreg细胞被静息处理并进一步用胰岛素治疗指定的时间段,结果发现HIF-1α表达在0.5小时的时间点增加并且是在PPAR-γ诱导之前进行的。正如之前报道的那样,HIF-1α可能会招募转录中介体复合物来刺激RNA聚合酶II(RNAPII)延伸并随后驱动基因转录,中介体复合物是一种多蛋白复合物,可连接转录因子和转录机制,尤其是转录中介体复合物23亚基能充当将胰岛素信号转导至PPAR-γ表达的特定链接。因此,该研究进行了结合研究并检测了HIF-1α和Med23之间的内源性相互作用,特别是在野生型Treg 细胞中,此外,使用染色质免疫沉淀(ChIP)测定,证实了在胰岛素刺激后HIF-1α–Med23–RNAPII (Rpb1)转录复合物与Pparg基因启动子的结合。
随后,进一步比较了来自Hif1afl/flFoxp3Cre(HKO)、Med23fl/flFoxp3Cre(MKO)和Foxp3Cre(WT)小鼠的脂肪Treg细胞发现,HKO和MKO脂肪Treg细胞显示出簇1基因(胞外5’-核苷酸酶(Nt5e)和Tcf7)的更高表达,同时下调簇2基因(Il1rl1、Pparg、Klrg1和Areg)。这些数据证明了胰岛素信号通过HIF-1α-Med23转录复合物发生以驱动PPAR-γ表达。
该研究揭示了胰岛素信号如何建立脂肪Treg细胞的发育心理轨迹,并揭示了CD73hiST2lo脂肪Treg细胞的独特生理影响,这些发现将扩大人们对组织Treg细胞亚群的理解并促进新疗法的开发,以治疗与年龄相关或饮食引起的胰岛素抵抗。(生物谷 bioon)
参考文献
Yangyang Li et al. Insulin signaling establishes a developmental trajectory of adipose regulatory T cells. NATURE IMMUNOLOGY(2021 Aug 24) doi:https://doi.org/10.1038/s41590-021-01010-3
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




