肠道微生物组研究进展(第9期)
来源:本站原创 2021-08-31 23:57
研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,小编针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
2021年8月31日讯/生物谷BIOON/---肠道是人体最大的消化和排毒器官,其回旋盘转的结构被形象地称为人体第二大脑。肠道中寄生着数以计亿的细菌,它们是人体内最重要的一种外环境,各种微生物按一定比例组合,相互制约,相互依存,在质和量上形成一种生态平衡。然而肠道菌群并不都是人类的朋友,按特性来讲,它们可分为3大类,即好菌、坏菌和中性菌。当人体肠道中好菌比例下降而坏菌数量上升时,人体免疫力下降,极易导致多种疾病的发生。
研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,小编针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
1.Science:揭示肠道微生物组中的肠球菌增强免疫检查点抑制剂的抗肿瘤反应机制
doi:10.1126/science.abc9113; doi:10.1126/science.abl3656
在一项新的研究中,来自美国洛克菲勒大学和斯克里普斯研究所等研究机构的研究人员发现在肠道微生物组中肠球菌属的成员能够改善小鼠肿瘤模型对免疫检查点抑制剂的反应。相关研究结果发表在2021年8月27日的Science期刊上,论文标题为“Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy”。

与疾病相关的肠道微生物群因年龄而异,图片来自eLife Science Digests。
综上所述,这些数据表明,具有专门的肽聚糖重塑活性的肠道微生物物种和基于胞壁肽的治疗方法可以增强癌症免疫治疗,并可能作为下一代佐剂加以利用。
2.Theranostics:益生菌通过组蛋白甲基化促进肥胖小鼠骨形成
doi:10.7150/thno.63749
肠道微生物群的操作可以防止病理性骨丢失。然而,益生菌对高脂饮食(HFD)相关肥胖的线粒体表观遗传学重塑和骨骼动态平衡的影响仍有待探索。在这里,作者通过高脂饲料喂养的肥胖小鼠的组蛋白甲基化机制研究了益生菌补充对线粒体生物发生和骨稳态的影响。总之,这些结果表明,益生菌介导的肠道微生物群及其衍生代谢物IPA可能是一种通过肠道-骨轴调节骨合成代谢的新药物。
这项工作提出并验证的假设是,通过补充益生菌来恢复肠道菌群的健康组成,可能在维持肥胖小鼠骨骼内环境平衡方面发挥重要作用。在本研究中,作者旨在通过益生菌治疗(VSL#3)恢复肥胖小鼠健康的肠道微生物区系组成(或优生菌),并减轻HFD引起的肠道微生物区系失调、通透性和血浆内毒素血症及其相关的骨骼丢失。这些数据表明,补充益生菌可以维持肠道中健康的微生物区系组成,保持肠道屏障的完整性,并改善骨环境中成骨细胞的矿化。从机制上讲,成骨细胞分化通过Tfam启动子上H3K27me3标记的高甲基化而表观遗传减弱。Tfam的高甲基化抑制加剧了糖酵解率和线粒体生物能代谢,进而抑制了成骨和骨形成,从而导致肥胖性代谢性骨质疏松症。用HFD喂养的TFAM转基因(TG)小鼠基本上避免了HFD诱导的成骨减少。这些发现揭示了益生菌通过调节肠道-骨轴促进骨骼动态平衡的先前未明确的新作用。
3.Cancer Cell:肠道真菌和肠道细菌对放疗的抗肿瘤作用产生不同的影响
doi:10.1016/j.ccell.2021.07.002
近年来,科学家们已发现,肠道中的细菌对化疗和免疫疗法的强劲反应是必要的,但它们对放射治疗(即放疗)的影响仍然是未知的。如今,在一项新的研究中,来自美国西达赛奈医学中心的研究人员发现不仅肠道细菌对放疗的抗肿瘤能力至关重要,而且肠道真菌是肠道微生物组中不太知名的成员,可能在抗肿瘤免疫反应中发挥额外的关键调节作用。这项研究代表了肠道真菌可能影响抗癌放疗的第一个证明。它是对该领域的重要贡献。相关研究结果近期发表在Cancer Cell期刊上,论文标题为“Commensal bacteria and fungi differentially regulate tumor responses to radiation therapy”。
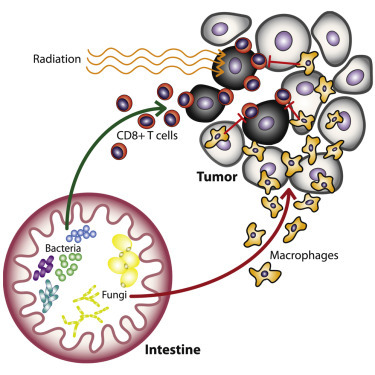
图片来自Cancer Cell, 2021, doi:10.1016/j.ccell.2021.07.002。
为了准确确定肠道真菌如何降低放疗效果,这些作者检查了接受不同治疗的小鼠体内的肿瘤的免疫细胞组成。与单独接受放疗的小鼠相比,接受放疗加抗真菌治疗的小鼠的肿瘤杀伤性CD8+T细胞有所增加。在接受抗生素加放疗的小鼠中,他们观察到攻击这些肿瘤杀伤性CD8+T细胞的肿瘤相关巨噬细胞增加。当他们将这些肿瘤杀伤性CD8+T细胞或肿瘤相关巨噬细胞从小鼠体内移除时,抗真菌剂失去了减缓肿瘤和延长生命的作用。
4.Cell子刊:肠道微生物群变化或可加剧认知能力下降
doi:10.1016/j.chom.2021.07.004
近期的研究已发现,肠道微生物群---生活在肠道中的数万亿个细菌和其他微生物---的变化可以改变大脑和行为。如今,在一项新的研究中,来自美国加州大学洛杉矶分校和加州理工学院的研究人员阐明了这一现象是如何和为何发生的。相关研究结果近期发表在Cell Host & Microbe期刊上,论文标题为“Alterations in the gut microbiota contribute to cognitive impairment induced by the ketogenic diet and hypoxia”。
在用小鼠进行的实验中,这些作者发现,肠道微生物可以加剧认知障碍的影响,因为它们会影响大脑中对记忆和学习至关重要的海马体。他们发现,在喂食生酮饮食---高脂肪、低碳水化合物的饮食---并间歇性缺氧的小鼠的肠道微生物群中,一类叫做嗜胆菌(Bilophila)的细菌浓度急剧增加。他们还发现,生酮饮食、缺氧和用一种叫做沃氏嗜胆菌(Bilophila wadsworthia)的嗜胆菌处理会损害海马体,导致小鼠的认知能力下降。
5.Hypertension:机体肠道微生物组或能部分解释摄入富含黄酮类化合物的食物对机体血压所产生的有益效应
doi:10.1161/HYPERTENSIONAHA.121.17441
我们都知道,摄入诸如水果和蔬菜等多种食物都能改善机体血压,近日,一篇发表在国际杂志Hypertension上题为“Microbial Diversity and Abundance of Parabacteroides Mediate the Associations Between Higher Intake of Flavonoid-Rich Foods and Lower Blood Pressure”的研究报告中,来自贝尔法斯特女王大学等机构的科学家们通过研究发现,诸如浆果、苹果、梨和葡萄酒等富含黄酮类的食物似乎对机体血压水平有着积极的影响,这种关联或许部分能通过肠道微生物组的特征来解释。
随着越来越多的研究表明黄酮类化合物或能降低机体心脏病的风险,本文研究评估了肠道微生物组在这一过程中所扮演的关键角色,研究人员分析了摄入富含黄酮类化合物的食物与机体血压和肠道微生物组多样性之间的关联,此外他们还调查了肠道微生物组内到底有多少差异能够解释摄入富含黄酮类化合物的食物与机体血压之间的关联。文章中,研究人员共招募了904名25-82岁之间的成年人进行研究,其中57%为男性,研究者在定期随访过程中评估了参与者的食物摄入量、肠道微生物组和其机体血压水平,以及其它临床和分子表型数据。
本文研究中,研究人员发现:1)摄入富含黄酮类化合物食物(包括浆果、红酒、苹果和梨)最多的参与者的收缩压水平较低,而与摄入水平最低的参与者相比,前者机体的肠道微生物组多样性水平较高;2)富含黄酮类化合物的食物和收缩压之间关联中有15.2%都通过参与者机体肠道微生物组的多样性来解释;3)每天摄入1.6份浆果(一份相当于80克或1杯)与参与者机体收缩压平均降低4.1毫米汞柱有关,而大约12%的关联能由肠道微生物组因子来解释;4)每周喝2.8杯(每杯125mL红酒)红葡萄酒与收缩压水平降低3.7毫米汞柱有关,其中15%的关联能通过肠道维生素组来解释。
6.Science:高脂肪饮食扰乱肠道内壁及其微生物群落,最终增加心血管疾病风险
doi:10.1126/science.aba3683
在一项新的研究中,来自美国范德堡大学医学中心和加州大学戴维斯分校等研究机构的研究人员发现高脂肪饮食扰乱了肠道内壁及其微生物群落的生物学特性,并促进了一种可能导致心脏病的代谢物的产生。这些在饮食诱导肥胖的小鼠模型中取得的发现支持肠道和肠道微生物群在心血管疾病产生中起着关键作用。相关研究结果发表在2021年8月13日的Science期刊上,论文标题为“High-fat diet–induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide”。
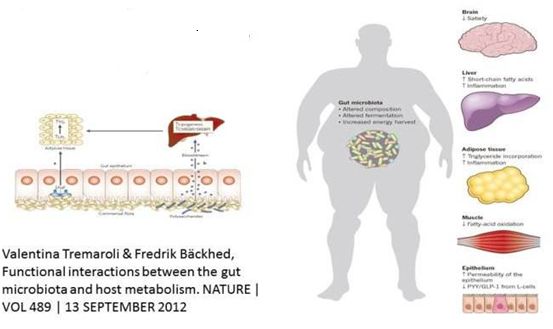
肠道微生物群与宿主代谢之间的功能性相互作用,图片来自Nature期刊。
这些作者证实,一种目前被批准用于治疗炎症性肠病的药物恢复了肠道上皮细胞的功能,并减弱了这种小鼠模型中的TMAO增加。这种称为5-氨基水杨酸(5-aminosalicylic acid)的药物能激活肠道上皮细胞中的线粒体生物能量。
Byndloss说,“这一证据表明,阻止与高脂肪饮食相关的负面结果是可能的。”她补充说,像5-氨基水杨酸这样的药物可能与益生菌一起使用,以恢复健康的肠道环境并提高有益微生物的水平。
7.Nature:揭秘肠道细菌利用死亡细胞所释放的营养物质作为燃料来引发宿主机体感染的分子机制
doi:10.1038/s41586-021-03785-9
调节性细胞死亡是生命的一个组成部分,其对有机体的发育和平衡有着非常广泛的影响;包括死亡细胞的清除在内的调节性细胞死亡过程的功能失调会表现为包括胃肠道在内的多种组织的病理学症状。细胞死亡和胃肠道病变之间存在着一种长期被重视但却并未阐明的关系,其中存在潜在的微生物成分,但研究人员并不清楚死亡的哺乳动物细胞对细菌生长的直接影响效应。
近日,一篇发表在国际杂志Nature上题为“Microbes exploit death-induced nutrient release by gut epithelial cells”的研究报告中,来自根特大学等机构的科学家们通过研究揭示了肠道细菌如何利用死亡细胞所释放的营养物质作为燃料来建立肠道感染。长期以来,研究人员一直在研究看似两个不同的研究领域,即特定细菌在人类机体肠道定植的机制,以及人类机体细胞死亡的机制。那么这两种过程之间存在着怎样的神秘关联呢?
研究者Kodi Ravichandran表示,几十年来我们一直知道,细胞死亡过程自身能通过改变机体的免疫反应从而间接影响细菌的感染;与此同时,研究人员还研究分析了死亡的细胞如何与其“邻居”之间进行交流沟通。如果这些死亡的细胞能够分泌特殊因子来被附近健康的细胞所识别并感知,那么到底有什么样的机制能阻断像肠道菌群一样的其它有机体来识别相同的分子呢?
利用细胞耒阳无和健康的小鼠组织系统,研究人员发现,当肠道上皮细胞开始死亡时,某些分子就会被主动产生并脱落;有意思的是,这些分子能被诸如沙门氏菌和大肠杆菌等肠道菌群直接感知和利用。研究人员表示,死亡细胞和肠道细菌之间的关联(研究者将其称之为死亡诱导的营养物质释放,DINNR),会发生在多个疾病背景下。肠道细菌能利用细胞死亡相关的分子来在多种情况下帮其定植,比如食物中毒、炎性疾病和化疗诱导的粘膜炎症;胃肠道毒性就是接受化疗的癌症患者所出现的一种主要的副作用,其或许需要改变剂量来降低疗效;此外,接受化疗的癌症患者发生后续感染的风险会明显增加。
8.Nature:百岁老人的独特肠道微生物组可能有助于长寿
doi:10.1038/s41586-021-03832-5
百岁老人不太容易受到与年龄有关的慢性疾病的影响,更有可能在传染病中存活下来。如今,一项新的研究显示,活到100岁或以上的人有一种独特的肠道微生物组,这种肠道微生物组可能会保护他们免受某些细菌感染,包括那些由耐多药细菌引起的感染。这些研究结果可能帮助人们开发治疗慢性炎症和细菌性疾病的新方法。相关研究结果于2021年7月29日在线发表在Nature期刊上,论文标题为“Novel bile acid biosynthetic pathways are enriched in the microbiome of centenarians”。论文通讯作者为日本庆应义塾大学医学院的Kenya Honda博士和美国布罗德研究所的Ramnik Xavier博士。
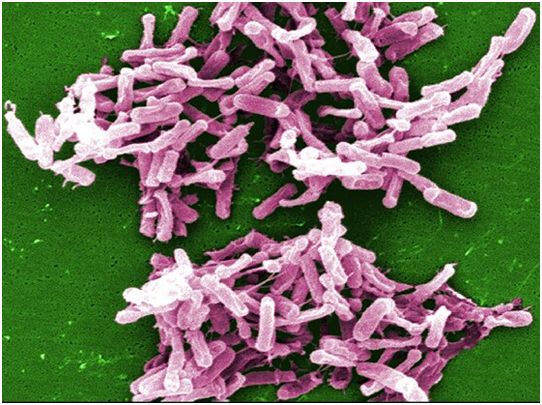
研究人员发现一种由百岁老人肠道微生物合成的化合物强烈抑制艰难梭菌(彩色)的生长,其中艰难梭菌可导致严重腹泻和肠道炎症。图片来自Janice Carr/CDC。
这些作者接下来在实验室里用百岁老人体内升高的次级胆汁酸来处理常见的致病细菌。其中的一种称为isoalloLCA的次级胆汁酸分子,强烈抑制了艰难梭菌的生长,其中艰难梭菌是一种抗生素耐药菌,会导致严重的腹泻和肠道炎症。给感染了艰难梭菌的小鼠喂食补充了IsoalloLCA的食物,同样抑制了这种病原菌的水平。他们还发现,IsoalloLCA有力地抑制了许多其他革兰氏阳性病原菌的生长或将其杀死,这表明IsoalloLCA可能有助于身体保持健康肠道中微生物群落的微妙平衡。
9.Hypertension:揭秘原发性高血压发病新机制!或与机体肠道微生物代谢通路的改变密切相关!
doi:10.1161/HYPERTENSIONAHA.121.17288
最近有研究证据表明,肠道微生物在高血压发病过程中扮演着关键角色,但动态血压(ambulatory blood pressure)是否与肠道微生物及其代谢产物有关,目前研究人员尚不清楚;近日,一篇发表在国际杂志Hypertension上题为“Essential Hypertension Is Associated With Changes in Gut Microbial Metabolic Pathways”的研究报告中,来自莫纳什大学等机构的科学家们通过研究发现,高血压患者机体的微生物遗传通路或许是有别于正常人群的。
此外,研究人员还发现,这些高血压患者机体肠道微生物中还缺失一种新识别出的靶向性基因,该基因能感知肠道微生物所衍生的代谢产物,从而帮助降低机体血压。如果不加以治疗的话,高血压就会导致中风和心肌梗塞,而这是诱发全球人群死亡的主要原因;长期以来我们都知道,高血压会引发动脉和心脏肌肉僵化,从而导致心力衰竭。这一点很重要,因为研究人员发现,心力衰竭患者机体往往拥有一种非常不同的肠道微生物组组成,而高血压是诱发心力衰竭的主要风险因子。
研究者Marques教授指出,高血压是引发心血管疾病的最常见的风险因素,文章中,我们在高血压水平和心力衰竭状况下评估了患者机体的肠道微生物,旨在更好地理解这些疾病发生的复杂特性;肠道卫生组的改变尤其与已知的产生短链脂肪酸的细菌有关,此前研究人员已经证明了短链脂肪酸能改善小鼠机体的血压和心脏疾病。
10.Nature:代谢产物乙酸盐或能帮助控制机体复杂的肠道菌群平衡
doi:10.1038/s41586-021-03727-5
细菌在肠道中的定植和抑制之间的平衡对于人类和细菌之间的共生关系必不可少;维持粘膜表面平衡的一个重要组分就是免疫球蛋白A(IgA),其是哺乳动物机体中最丰富的免疫球蛋白;多项研究揭示了多反应性IgA的重要特征,其是在没有共生细菌的情况下自然产生的,然而,考虑到肠道环境中的动态变化,目前研究人员仍然不能确定共生反应性IgA是如何形成的,以及这种IgA如何影响机体的微生物群落。
近日,一篇发表在国际杂志Nature上题为“Acetate differentially regulates IgA reactivity to commensal bacteria”的研究报告中,来自日本理化学研究所等机构的科学家们通过研究发现,某些肠道菌群所产生的主要代谢产物—乙酸盐或参与到了调节其它肠道菌群的过程中;尤其是,实验结果显示,乙酸盐或能诱发机体抵御有害细菌的免疫反应,相关研究结果或能帮助开发新型疗法来调节机体肠道菌群的平衡。
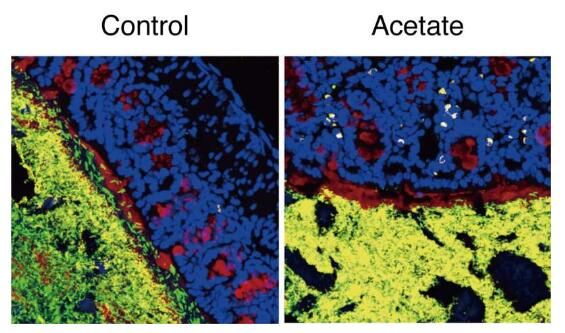
乙酸盐会增加IgA的产生,详见图中黄体表示。图片来源:RIKEN。
研究者指出,包括乙酸盐在内的SCFAs都能很容易被胃部和近端小肠组织吸收;因此这就很难研究口服SCFAs在远端肠道(比如结肠组织)中的影响了,因为在结肠等远端组织中SCFAs的水平较高。此外,研究人员还开发了一种方法来将代谢产物有效运输至远端肠道,这或许就能帮助他们分析SCFAs对机体免疫系统的影响效应,而诸如丙酸或丁酸等其它SCFAs则并不会影响IgA。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


