胆管癌精准治疗!美国FDA批准施维雅首创IDH1抑制剂Tibsovo:治疗IDH1突变患者,基石药业30亿引进中国!
来源:本站原创 2021-08-26 22:05
Tibsovo是第一个用于先前接受过治疗的IDH1突变胆管癌的靶向疗法。2018年6月,基石药业签署协议引进大中华区开发。
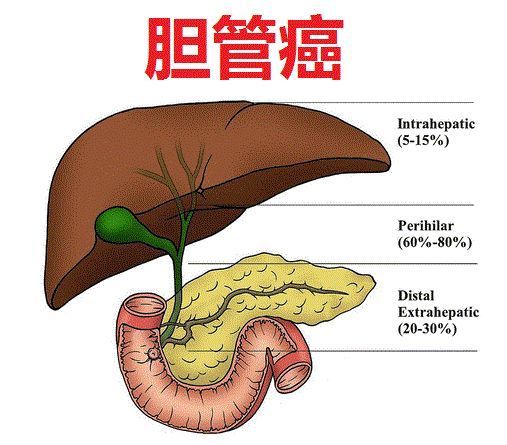
胆管癌-cholangiocarcinoma
2021年08月26日讯 /生物谷BIOON/ --施维雅(Servier)美国商业子公司Servier Pharmaceuticals近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Tibsovo(ivosidenib)一个新的适应症:用于治疗先前已接受过治疗、异柠檬酸脱氢酶-1(IDH1)突变的局部晚期或转移性胆管癌(cholangiocarcinoma,CCA)成人患者。
该适应症通过优先审查程序获得批准。值得一提的是,Tibsovo是第一个也是唯一一个被批准用于先前接受过治疗的IDH1突变胆管癌患者的靶向疗法。在Tibsovo批准之前,还没有针对IDH1突变胆管癌的系统疗法获得批准。对于晚期患者,可用的化疗方案非常有限。此次批准,为胆管癌社区带来了新的希望,将为患者提供一种急需的新治疗方案。用药方面,Tibsovo的推荐剂量为500mg,每日一次,可与或不与食物同服,直到疾病进展或出现不可接受的毒性。
在同一日,FDA还批准了赛默飞世尔科技公司Oncomine Dx Target Test作为Tibsovo的伴随诊断产品。Oncomine Dx Target Test是一款基于下一代测序(NGS)的检测产品,此次批准扩大了该检测产品的临床应用,可用于识别出存在IDH1突变的胆管癌患者,这些患者可能从Tibsovo治疗中获益。
Servier Pharmaceuticals首席执行官David K. Lee表示:“施维雅一直致力于探索抑制突变IDH酶的巨大潜力,将其作为一种新的方法,用于治疗医疗需求高度未满足的癌症,包括胆管癌。我们自豪地为患者带来了第一个也是唯一一个针对先前治疗过的IDH1突变胆管癌的靶向治疗。我们感谢通过参与ClarIDHy临床试验而取得这一成就的患者、护理人员、研究人员和研究团队。”
Tibsovo是由Agios制药公司开发的一款同类首创的、具有选择性的、针对IDH1基因突变癌症的强效口服靶向抑制剂。IDH1是一种代谢酶,其基因突变存在于包括急性髓性白血病(AML)、胆管癌和神经胶质瘤在内的多种肿瘤。
2018年6月底,基石药业与Agios签署了独家合作与授权协议,获得了Tibsovo在大中华区的独家权利。基石药业将负责Tibsovo在大中华区针对血液肿瘤和实体瘤适应症的临床开发和商业化。
2018年7月,Tibsovo获美国FDA批准,用于经一款检测方法(雅培RealTime IDH1伴随诊断试剂盒)证实存在IDH1突变的复发性或难治性急性髓系白血病(R/R AML)成人患者。此次批准,使Tibsovo成为首个获得FDA批准治疗IDH1突变R/R AML的药物。
2020年12月,施维雅与Agios达成一项协议,以20亿美元收购Agios的肿瘤业务,涵盖其商业化、临床、研究阶段的肿瘤药物。此次出售对Agios来说意义非凡,是战略调整的重要转型。
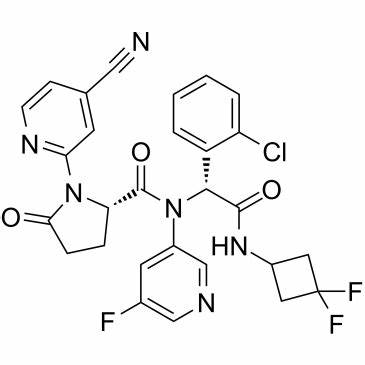
ivosidenib化学结构式(图片来源:medchemexpress.com)
此次新适应症批准,基于全球3期ClarIDHy试验的数据支持。这是第一个也是唯一一个针对先前治疗过的IDH1突变胆管癌患者开展的3期随机试验。入组的这些患者先前在接受过1种或2种系统疗法后出现疾病进展。研究中,患者以2:1的比例随机分配,接受Tibsovo(500mg,每日一次)或安慰剂治疗。安慰剂组患者在记录到影像学进展时允许交叉使用Tibsovo治疗。该试验的主要终点是:通过独立放射学评估确定的无进展生存率(PFS)。次要终点包括:研究者评估的PFS、安全性和耐受性、总缓解率(ORR)、总生存期(OS)、缓解持续时间(DOR)、药代动力学、药效学和生活质量评估。
截至2020年5月31日,共有187名患者被随机分组,其中126名患者在Tibsovo组,61名患者在安慰剂组。43例随机接受安慰剂治疗的患者(70.5%)在影像学疾病进展和揭盲后交叉使用开放标签Tibsovo治疗。
结果显示,该研究达到了主要终点:与安慰剂组,Tibsovo组在无进展生存期(PFS)方面有统计学意义的显著改善(中位PFS:2.7个月 vs 1.4个月;HR=0.37;95%CI:0.25-0.54;p<0.0001)。Tibsovo治疗组在6个月和12个月时估计的无进展生存率分别为32%和22%,而安慰剂组没有患者在6个月后疾病没有进展或死亡。
今年1月公布的最终分析显示,与安慰剂组相比,Tibsovo治疗组患者在次要终点OS方面表现出改善,但没有达到统计学意义。具体数据为:Tibsovo治疗组患者中位OS为10.3个月,安慰剂组患者中位OS为7.5个月(HR=0.79;95%CI:0.56-1.12;单侧p=0.093)。该OS数据没有对交叉(从安慰剂组转为Tibsovo组)进行调整。
值得一提的是,临床方案规定,接受安慰剂治疗的患者在疾病进展时可以转向Tibsovo治疗,事实上,在安慰剂组中有高比例的患者(70.5%)转向了Tibsovo治疗。根据保秩结构失效时间(RPSFT)模型,预先指定的交叉调整分析结果显示,安慰剂组患者的中位OS为5.1个月(HR=0.49,95%CI 0.34–0.70,单侧p<0.0001)。研究中观察到的安全性与先前公布的数据一致。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


