多篇文章聚焦lncRNAs与人类健康的密切关联!
来源:本站原创 2021-07-30 17:48
长链非编码RNA(lncRNAs)因其重要的调控功能而受到全球科学家们的广泛关注,许多研究都表明,lncRNAs与多种人类疾病有千丝万缕的关系,其或会通过调控基因的转录,或会调节蛋白的功能。本文中,小编就整理了多篇研究报告,共同解读长链非编码RNA与人类健康的密切关联,分享给大家!基因组扩增和转录激活通过E2F1驱动平面的表达在不同的癌症类型中上调。图片来源
长链非编码RNA(lncRNAs)因其重要的调控功能而受到全球科学家们的广泛关注,许多研究都表明,lncRNAs与多种人类疾病有千丝万缕的关系,其或会通过调控基因的转录,或会调节蛋白的功能。本文中,小编就整理了多篇研究报告,共同解读长链非编码RNA与人类健康的密切关联,分享给大家!
基因组扩增和转录激活通过E2F1驱动平面的表达在不同的癌症类型中上调。
图片来源:https://doi.org/10.1038/s41467-021-24099-4
【1】Nature子刊:泛癌lncRNA PLANE调节另一种剪接程序以促进癌症的发生
doi:10.1038/s41467-021-24099-4
染色体3Q末端的基因组扩增编码多种致癌蛋白,是恶性肿瘤中最常见的染色体异常之一。在这里,作者从功能上描述了3Q区域的一个非蛋白质产物,长非编码RNA(LncRNA)平面,它通过拷贝数增加以及E2F1介导的转录激活在不同的癌症类型中上调。PLAN在第45内含子与核受体辅助抑制因子2(NCOR2)前mRNA形成RNA-RNA双链,与异质性核糖核蛋白M(HnRNPM)结合,促进hnRNPM与内含子的结合,从而抑制产生NCOR2-202的选择性剪接(AS)事件,NCOR2-202是编码NCOR2作为变异体的主要蛋白质。这至少在一定程度上是平面介导的促进癌细胞增殖和致瘤性的原因。这些结果揭示了Plane的功能和调节,提示Plane可能成为泛癌的治疗靶点。
前体mRNAs的交替剪接(As)是一种基本的机制,它允许从单个基因产生不同的成熟转录本,从而扩大基因编码能力,增加功能多样性。超过95%的人类多外显子基因经历AS,这是由被称为剪接因子的反式蛋白与顺式作用核苷酸序列的相互作用严格控制的。剪接因子包括丝氨酸-精氨酸(SR)蛋白家族成员和异质核糖核蛋白(HnRNP),它们通过与被归类为增强剂或沉默剂的外显子或内含子调控序列相互作用,促进或抑制特定的剪接事件。异常AS事件通过放松对细胞生存和增殖等基本细胞过程的调控,参与包括癌症在内的许多疾病的发病。
核受体共抑制因子2(NCOR2)又称视黄醇和甲状腺激素受体沉默介质(SMRT)或T3受体相关辅因子1(TRAC-1),是组装抑制靶基因反式激活的功能复合体的中枢组织平台。NCOR2 N端抑制域招募其他转录辅助抑制物,如组蛋白脱乙酰化酶(HDAC),而其CTr相互作用域与核受体(如甲状腺激素受体和维甲酸受体)相互作用。此外,NCOR2介导的抑制也针对其他转录因子激活的基因,如AP-1和NF-κB。在保留其抑制结构域的情况下,NCOR2通过其末端AS对不同转录因子表现出不同的亲和力。值得注意的是,癌细胞经常表现出NCOR2表达的改变,这暗示了NCOR2的失控在癌症发病机制中的作用。例如,NCOR2在多发性骨髓瘤中表达下调,其低表达与非霍奇金淋巴瘤的发生和肺腺癌(LUAD)患者的预后不良有关。相反,NCOR2的高表达与乳腺癌的早期复发(BRCA)有关。
【2】Trends Endocrinol Metab:代谢性疾病中的长链非编码RNA:从实验到临床
doi:10.1016/j.tem.2021.05.009
长非编码RNA(LncRNAs)因其在生理和疾病环境中的意义而被广泛研究,但其在代谢性疾病中的功能和治疗潜力还远未阐明。本文就lncRNAs的识别、功能、作为生物标志物的作用以及在代谢性疾病中的治疗前景等方面的研究进展作一综述。最初将非编码基因组定义为垃圾DNA是不可能的,因为基因组中这一重要部分的潜在功能是无穷无尽的。LncRNA被定义为长度超过200bp的ncRNA分子,其在基因表达调控中的折衷作用现在被赋予了至关重要的相关性。lncrna在哺乳动物不同的发育阶段具有不同的富集程度,具有特定的时空表达模式。此外,它们并不总是普遍存在于人体中,越来越多的器官和线条特异的lncRNA已经被识别出来。据报道,lncRNA在脂肪生成和代谢性疾病中都起作用,从肥胖到2型糖尿病、心血管疾病(Cvd)、骨关节炎、高血压、肝脏代谢疾病和血脂异常。
高通量筛查的最大优势之一是有可能识别出新的候选疾病。这些筛查研究中,当在人体上进行时,都是在体液上进行的,很容易在没有侵入性技术的情况下取回。在这一领域,最重要的进展是心血管疾病。当在ClinicalTrials.gov数据库中搜索术语lncRNA和生物标记物时,出现了24项研究。其中8例与代谢性疾病有关,5例与心血管疾病有关(NCT04175691、NCT04230785、NCT03268135、NCT02915315和NCT03225183),各1例与糖尿病周围神经病变(NCT04638556)、慢性肾病(NCT02304471)和骨关节炎(NCT03726918)有关。此外,rna-seq研究的结果还可能导致确定其他相关的代谢性疾病的生物标志物,目前正在开发计算方法,以便将与疾病相关的lncRNA识别为潜在的生物标志物和可能的治疗靶点。
doi:10.1038/s41568-021-00353-1
华盛顿大学研究者在Nature Reviews Cancer杂志上发表了题为"Long noncoding RNAs in cancer metastasis"综述性文章。长链非编码RNA在癌症转移中的作用。作者除了介绍了lncRNA在转移中发挥作用的典型例子外,还讨论了lncRNA生物学中存在的争议和正在面临的挑战。最后,作者还提出了这一快速发展领域的未来研究领域。
转移性疾病是癌症相关死亡的绝大多数原因。尽管癌症的诊断和治疗取得了进展,但转移性癌症患者的预后仍然很差,某些癌症的中位生存时间以月为单位。癌细胞从原发肿瘤向远处器官的扩散涉及一个协调的、多步骤的过程,称为侵袭转移级联。首先,原发肿瘤细胞必须局部侵入周围正常组织。然后,这些细胞内渗进入体循环,随后在远处的部位外渗,转移细胞需要在通常为外来的组织环境中增殖和定植。
长非编码RNA (lncRNAs)在操作上被定义为长度超过200个核苷酸的RNA转录本,并且没有证据表明它们编码多肽。虽然lncRNA最初仅被描述为基因间转录物,但现在它包括自然反义转录物、重叠转录物和内含子转录物等,这取决于lncRNA相对于附近的蛋白质编码基因的基因组排列。成千上万的lncrna已经被高通量RNA测序鉴定出来,但只有一小部分被功能表征。通过对肿瘤样本的差异表达分析和比较转录组学研究,多种lncrna已被优先用于功能研究,揭示了表型和机制的多样性。
图片来源:Shiyang Liu, et al. Genome Medicine (2020). DOI:10.1186/s13073-020-00788-5
【4】Genome Med:揭秘lncRNAs在胰腺癌发生过程中所扮演的关键角色
doi:10.1186/s13073-020-00788-5
长期以来长链RNA分子一直被认为是人类基因组中的一个谜,因为其携带有不能被翻译成为蛋白质的DNA代码,近日,一篇刊登在国际杂志Genome Medicine上的研究报告中,来自杜克-新加坡国立大学等机构的科学家们通过研究发现了一种能系统性调查长链RNA分子的方法,此外研究者还发现,某些长链RNA分子在胰腺癌发生过程中扮演着关键的角色,相关研究结果强调了调查生物体中长链非编码RNA(lncRNAs)所扮演角色的重要性。
RNA被认为是一种中间分子,即DNA会转录成为RNA分子,随后再翻译成为蛋白质;研究者表示,在人类基因组的30亿个碱基对中,仅有2%的遗传代码会编码蛋白质,其余98%的基因组代码都是非编码性的,而且其一度被认为是人类基因组中的暗物质,即并没有已知的功能,作为基因组暗物质的主要组分,某些lncRNAs在从机体发育到疾病发生多个生物学过程中扮演着非常关键的角色。
研究者Shiyang Liu说道,通过结合多种先进的工具,我们就能调查与胰腺癌发生相关的基因组暗物质所扮演的角色和功能;尤其是我们想通过研究识别能被Wnt信号通路所调节的lncRNAs,该信号通路能调节编码蛋白产生的多种基因的表达,但目前研究人员并不清楚其对lncRNAs的影响。Wnt信号能够促进某些胰腺癌的生长,而关闭该通路不仅能帮助治疗胰腺癌,还能帮助科学家们识别出被该信号所调节的基因组区域。
【5】Cell综述:深度解读lncRNAs的奥秘!既保守又不保守!
doi:10.1016/j.cell.2020.04.012
近日,一项刊登在国际杂志Cell上题为“The Secret Life of lncRNAs: Conserved, yet Not Conserved”的综述报告中,来自日本RIKEN综合医学科学中心的科学家们论述了lncRNAs的奥秘。此前研究人员Guo等人发现了lncRNA进化的一个新的层面,在人类胚胎干细胞中处于保守位置的lncRNAs会被广泛剪接并输出到细胞质中,而在小鼠中其主要是未剪接且能保留细胞核,因此,独特的加工过程会导致在多能性维持中出现物种特异性的lncRNA功能。
大多数的非编码RNAs(lncRNAs)都会快速进化,正如最近研究人员对哺乳动物和非哺乳动物lncRNAs的比较研究中回顾的那样,尽管如此,成千上万的哺乳动物lncRNAs在序列或基因组位置及启动子水平上都处于保守状态,此外,其功能还会受到亚细胞定位的影响,因为lncRNAs能在细胞核和细胞质中形成复杂的调节网络,从而调节多种细胞过程,尽管如此,对lncRNA的处理和功能的种间比较分析在很大程度上并未得到探索,这篇综述文章中,研究人员就报告发现,一组在人类胚胎干细胞中表达保守的lncRNAs与小鼠胚胎干细胞中的lncRNAs在加工方式上或许并不相同,从而就导致了不同的亚细胞定位和功能,研究者识别出了122个序列保守和229个位置保守的lncRNAs,其在小鼠胚胎干细胞中(mESCs)相比人类胚胎干细胞(hESCs)更倾向于保守,相反,hESCs的lncRNAs会被更频繁地剪接,从而就会导致细胞质输出和定位的偏好,这在某种程度上是预期发生的,因为剪接和mRNA的输出之间存在一定的相关性。
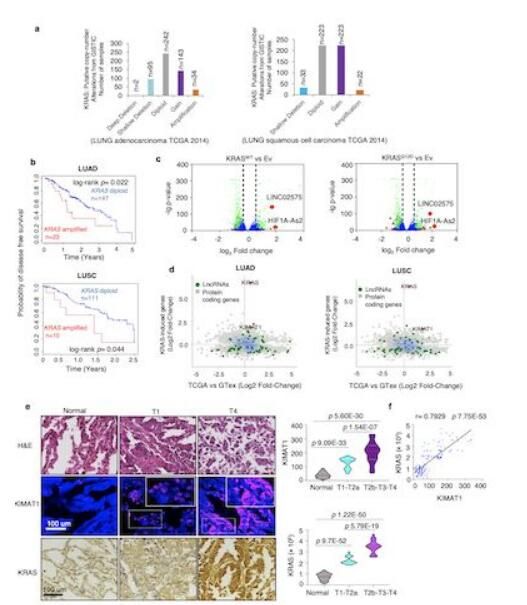
鉴定与KRAS相关的lncRNA分子。
图片来源:doi:10.1038/s41467-021-22337-3
【6】Nat Commun:lncRNA调控肺癌细胞KRAS信号传递的内在机制
doi:10.1038/s41467-021-22337-3
野生型KRAS基因的复制被认为是癌细胞中KRAS激活的手段之一,往往伴随着患者存活率的下降。然而,野生型KRAS基因过表达与肺癌恶化之间的关系目前并不清楚。在最近发表于《Nature Comunications》杂志上的一项研究中,来自英国曼彻斯特大学的Michela Garofalo教授等人揭示了一种能够响应KRAS的lncRNA(KIMAT1),后者在细胞内的水平与KRAS的水平存在高度相关性。进一步研究表明,KIMAT1作为MYC的靶标,能够驱动肺脏肿瘤发生,而该效应是通过促进癌基因相关mRNA分子的加工以及抑制抑肿瘤相关miRNA的加工而达成的,DHX9与NPM1在此过程中扮演了相当重要的角色。
首先,研究者们对肺腺癌(LUAD)以及肺鳞癌(LUSC)患者来源的样本进行了基因组水平的分析,发现其中KRAS的拷贝数均明显高与正常群体。进一步分析表明,拥有较高KRAS拷贝数的肺癌患者村湖绿明显低于正常拷贝数的肺癌患者。通过对KRAS诱导的lncRNA进行分析,作者发现其中排名最高的是名为KIMAT1的分子。KIMT1全长912nt,编码KIMT1的DNA序列位于21号染色体上,并且仅存在一个可变剪接体。此外,作者发现随着KRAS表达水平的升高,KIMAT1的表达量也会有明显上升,而沉默KRAS则会导致KIMAT1的表达量下调。这些结果表明KIMAT1受到KRAS的调节。
【7】Cell:中国科学家lncRNAs研究获重大突破!lncRNAs不同的加工方式或会促进其在干细胞中的非保守功能
doi:10.1016/j.cell.2020.03.006
长链非编码RNAs(lncRNAs)长度超过200个核苷酸,其缺乏蛋白质编码潜能,在真核细胞基因中会广泛转录,目前有研究表明,lncRNAs在多种细胞和生物学进程的基因表达过程中扮演着关键角色。与保守的mRNAs不同的是,lncRNAs普遍缺少对基本序列的高度约束,而且其要比mRNAs进化地更快,因此,从基本序列、外显子结构、基因组未知到作用机制,lncRNAs的保守性发生在不同的水平,目前研究人员并不清楚保守的lncRNAs是否会经过保守的加工、定位和功能表现。
日前,一项刊登在国际杂志Cell上的研究报告中,来自中国科学院上海生化细胞所陈玲玲研究团队通过研究发现,lncRNAs同源序列的不同处理方式会引发其在人类和小鼠胚胎干细胞中不同的亚细胞定位,随后会导致其在不同物种中多能性调控方面的功能差异。相关研究结果表明,保守的lncRNAs或会通过非保守的RNA处理和定位过程实现功能性的进化。
通过对人类和小鼠胚胎干细胞中细胞质和细胞核分离RNAs的分析,研究者揭示了这些细胞中序列保守和位置保守lncRNAs的不同亚细胞定位模式,而且与小鼠相比,人类的胚胎干细胞中有更高比例的lncRNAs会被剪接并输出到细胞质中,这对于人类胚胎干细胞的多能性非常重要。
【8】Science子刊:增加lncRNA SNHG12水平有望治疗动脉粥样硬化
doi:10.1126/scitranslmed.aaw1868
在一项新的研究中,来自美国哈佛医学院、布莱根妇女医院、达纳法伯癌症研究所、中国中南大学、加拿大多伦多大学、意大利乌尔比诺大学和瑞士洛桑联邦高等理工学院的研究人员通过研究基因组中的“垃圾DNA”取得了一项潜在激动人心的新发现。人类基因组中大约75%的区域不会编码蛋白,之前一度被视为垃圾DNA。但是,它们远不是垃圾,相反,它们可能提供着有关疾病状态的诱人线索。他们深入地研究这些区域,以寻找有关动脉粥样硬化的线索,其中动脉粥样硬化是一种让动脉变得越来越硬化和狭窄而阻碍血液流动并导致心脏病的疾病。他们发现一种长链非编码RNA(lncRNA)可能为开发针对动脉粥样硬化的新疗法指明了方向,并阐明了这种疾病发生的可能性为何随着年龄的增加而增加。相关研究结果发表在2020年2月19日的Science Translational Medicine期刊上,论文标题为“Long noncoding RNA SNHG12 integrates a DNA-PK–mediated DNA damage response and vascular senescence”。
Feinberg说,“我们鉴定出一种控制血管壁衰老的新因子,令人惊讶的是,它不是传统的基因或蛋白。它是非编码基因组的一部分。这是意想不到的。我们对胆固醇和炎症在心脏病中的重要性了解很多,但这是一条新的额外途径。我们需要仔细考虑它如何可能影响开发针对心血管疾病的治疗方法。”Feinberg及其同事们使用了一种动脉粥样硬化小鼠模型,其中这些小鼠在12周大时开始出现动脉粥样硬化病变。他们从血管壁最内层分离出RNA,并观察整个基因组所编码的所有RNA,以便寻找在疾病进展或消退过程中哪些RNA的活性发生了变化。其中活性动态变化最为明显的RNA之一是SNHG12:它是一种lncRNA,不编码蛋白,但可在人类、猪和小鼠等多种物种中发现。
图片来源:Nature Immunology, 2019, doi:10.1038/s41590-019-0406-1。
【9】Nat Immunol:揭示CCR5AS lncRNA多态性影响HIV感染
doi:10.1038/s41590-019-0406-1
人类免疫缺陷病毒(HIV),即艾滋病病毒,是导致获得性免疫缺陷综合征(AIDS,俗称艾滋病)的病毒。HIV感染仍然是主要的公共卫生负担。仅在美国就有一百多万人感染HIV,而且每年报道的新病例超过5万例。在一项新的研究中,美国德州生物医学研究所助理教授Smita Kulkarni博士和美国弗雷德里克国家癌症研究实验室的Mary Carrington博士领导的一个研究团队确定了一种长链非编码RNA(lncRNA)影响一种参与HIV感染和疾病进展的关键受体。这种新鉴定出的机制可能为控制HIV感染开辟了一条新的途径。相关研究结果发表在2019年7月的Nature Immunology期刊上,论文标题为“CCR5AS lncRNA variation differentially regulates CCR5, influencing HIV disease outcome”。
基因组的大部分由非编码RNA组成,这些非编码RNA不能直接翻译为蛋白。事实上,97%的人类基因组不能编码蛋白。Kulkarni说,直到最近十年左右,科学家们才知道这些特殊RNA中的多数并非“垃圾”。如今,这项新的研究表明它们发挥着很多作用。近期在技术和基因组学方面的突破使得这一领域取得了新进展。
Kulkarni和她的同事们发现一种称为CCR5AS的特定lncRNA影响编码HIV辅助受体CCR5的基因。鉴于CCR5对于HIV病毒侵入细胞至关重要,因此与这种lncRNA的表达变化相关联的多态性会影响HIV感染的结果。来自西班牙裔美国人、非洲裔美国人和日本人等各种群体的基因组DNA表明这种关联性存在于许多种族中。这种关联性在不同人群中的一致性表明存在一种解释这种关联性的单个功能性机制。
【10】Nature:揭示哺乳动物器官中lncRNA在发育期间的动态变化
doi:10.1038/s41586-019-1341-x
虽然科学家们已经在人类和其他哺乳动物的基因组中鉴定了许多长链非编码(lncRNA),但是对lncRNA的功能进行了有限的系统性描述。特别是,lncRNA对器官发育的贡献在很大程度上仍未得到探索。在一项新的研究中,来自德国海德堡大学和瑞士洛桑大学的研究人员分析了来自7种物种(人类、恒河猴、小鼠、大鼠、兔子、负鼠和鸡)的7种主要器官在不同的发育时间点(从早期的器官发生到成年时)的lncRNA表达模式。他们的分析在每种物种中鉴定出大约15000~35000个候选lncRNA,其中的大多数显示出物种特异性。相关研究结果发表在Nature期刊上,论文标题为“Developmental dynamics of lncRNAs across mammalian organs and species”。
这些研究人员描述了lncRNA在不同发育阶段的表达模式,并发现许多随着时间的推移具有动态表达模式lncRNA表现出功能丰富的特征。他们还发现在发育期间,广泛表达的和保守的lncRNA向越来越多的谱系和器官特异性的lncRNA转变。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。