HIV新药!吉利德Biktarvy(必妥维®)在初治HIV-1成人中治疗4年显示高疗效持久病毒抑制,已在中国上市!
来源:本站原创 2021-07-19 01:39
Biktarvy(必妥维)是一款三合一复方新药,已于2018年10月、2019年8月在中国香港、大陆上市。

2021年07月19日讯 /生物谷BIOON/ --吉利德科学(Gilead Sciences)近日在2021年第11届国际艾滋病协会(IAS)HIV科学会议上公布了三合一复方新药Biktarvy(中文商品名:必妥维®,通用名:比克恩丙诺片,比克替拉韦50mg/恩曲他滨200mg/丙酚替诺福韦25mg,BIC/FTC/TAF)2项随机、双盲、阳性药物对照III期研究(研究1489和研究1490)48周开放标签扩展期(OLE)的汇总分析数据。
Biktarvy是指南推荐用于HIV-1患者的单片完整治疗方案。汇总分析数据显示,在先前没有接受过HIV药物治疗(treatment-naive,初治)的HIV-1成人感染者中,Biktarvy治疗4年(192周)具有高疗效和持久的病毒抑制作用,99%的患者达到并维持病毒学抑制,没有出现因治疗对Biktarvy任何组分产生耐药性的病例。
2项研究中,1274例初治成人患者被随机分配,接受Biktarvy(n=634)或多替拉韦(dolutegravir,DTG)三联疗法(n=640),治疗144周。研究1489中,DTG三联疗法为:多替拉韦/阿巴卡韦/拉米夫定(50/600/300 mg,DTG/ABC/3TC);研究1490中,DTG三联疗法为:DTG+恩曲他滨/丙酚替诺福韦(50/200/25 mg,DTG+F/TAF)。2项研究的主要终点均为治疗第48周的病毒学抑制率。
之前已公布的数据显示,2项研究在第48周均达到了主要终点:在初治HIV-1成人感染者中,Biktarvy与2种DTG三联疗法(DTGABC/3TC方案,DTG+F/TAF方案)在疗效方面具有非劣效性。在第144周对治疗结果也进行了评估,也显示Biktarvy与2种DTG三联疗法在疗效方面具有非劣效性:2组患者均达到了无法检测的病毒载量,并且没有出现治疗引起的耐药性。在完成144周治疗后进行揭盲,之后所有患者进入开放标签扩展期(OLE)接受Biktarvy治疗可长达96周。目前,2项研究正在进行中。
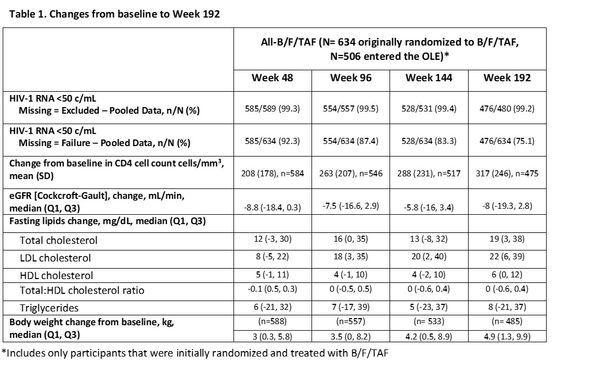
初治成人患者4年治疗数据
此次会议上,公布了2项研究中从最初随机分配至Biktarvy治疗直至第192周(144周+48周)的患者汇总结果,即OLE部分第48周汇总结果。数据显示,通过4年(192周,n=476/480,缺失=排除)的随访,99.2%的患者维持无法检测到的病毒载量(即:病毒学抑制,HIV-1 RNA<50拷贝/毫升)、CD4细胞计数的中位数较基线增加了289个细胞/微升,没有患者发生耐药导致的治疗失败。
安全性方面,79%的治疗期不良事件(TEAE)为1级或2级,最常见的是腹泻、鼻咽炎、头痛、上呼吸道感染和梅毒。不良事件导致1%(n=7)的患者停药。从基线检查到第192周,体重变化的中位数(Q1,Q3)为增加4.9公斤(1.3,9.9),治疗第一年体重增加3公斤(0.3,5.8)。
结论:经过4年的随访,Biktarvy治疗显示出高疗效和持久病毒学抑制,无治疗引起的耐药性,不良事件发生率低,停药少。
Biktarvy是一种每日口服一次的单一片剂方案(STR),用于治疗HIV-1感染。该药结合了新型整合酶链转移抑制剂(INSTI)bictegravir(BIC)的效力和已上市药物Descovy(emtricitabine 200 mg/tenofovir alafenamide 25 mg,FTC/TAF)已被证明的疗效和安全性,后者是HIV临床治疗指南推荐的双效核苷类逆转录酶抑制剂(NRTI)骨架疗法。在3期临床研究中,用于治疗既往未接受治疗(初治)的患者以及实现病毒学抑制并切换治疗方案(经治)的患者时,Biktarvy均实现了非常高的病毒学抑制率,并且没有发生治疗出现的耐药性。
在美国,Biktarvy于2018年2月获批上市,该药适应症为:作为一种完整方案,用于治疗HIV-1感染的儿科患者(体重≥25公斤)和成人患者,这些患者无治疗失败史,并且不存在已知的对Biktarvy每个组份耐药相关的突变。具体为:(1)无抗逆转录病毒治疗史的患者;(2)接受稳定的抗逆转录病毒方案已实现病毒学抑制的患者,取代其当前的抗逆转录病毒方案。需要指出的是,Biktarvy的药物标签附有一则黑框警告,提示治疗后乙型肝炎急性恶化的风险。
在中国,Biktarvy(必妥维®)于2018年10月获得香港批准,于2019年8月获得大陆批准。必妥维®在中国适用于作为完整方案治疗人类免疫缺陷病毒1型(HIV-1)感染的成人,且患者目前和既往无对整合酶抑制剂类药物、恩曲他滨或替诺福韦产生病毒耐药性的证据。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


