研究发现精氨酸甲基化在RNA剪接和翻译全局调控中的关键作用
来源:上海营养与健康研究所 2021-07-16 12:13
7月15日,中国科学院上海营养与健康研究所研究员王泽峰课题组在Science Bulletin上发表了题为A systematic survey of PRMT interactomes reveals the key roles of arginine methylation in the global control of RNA
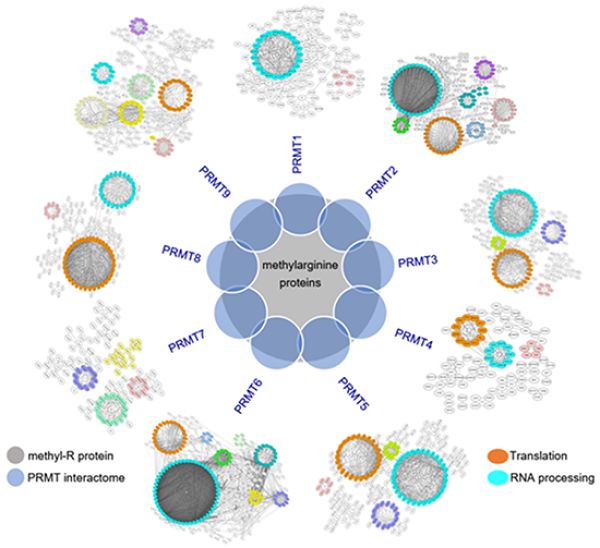
7月15日,中国科学院上海营养与健康研究所研究员王泽峰课题组在Science Bulletin上发表了题为A systematic survey of PRMT interactomes reveals the key roles of arginine methylation in the global control of RNA splicing and translation的研究论文。该研究应用蛋白质组学技术系统性鉴定了人类细胞中已知的所有9个蛋白精氨酸甲基转移酶(PRMT)的互作蛋白,并利用多种测序技术(包括RNA测序和核糖体印迹测序等),结合生物信息学分析,证明了PRMT在mRNA剪接和翻译中发挥重要作用。
PRMT家族是一类可将精氨酸胍基上氮原子进行单甲基和双甲基修饰的酶类,根据甲基化产物不同,主要分为I型和II型。目前在哺乳动物中只发现9个成员。早期研究发现,它们能够使组蛋白甲基化,从而影响基因转录、细胞增殖分化等生物学过程。随着组学等技术的发展,越来越多的非组蛋白也被鉴定出含有甲基化精氨酸。但是,由于缺乏可靠的抗体以及机制明确的去甲基酶和识别蛋白,这在一定程度上限制了精氨酸甲基化的分子机制和生物学功能研究。
研究显示,人类PRMT互作组和已知的含甲基精氨酸的蛋白质高度重叠,且不同PRMT之间有补偿效应,主要表现为它们底物之间显着重叠,并且底物甲基化基序也具有高度相似性。研究发现,PRMT的催化底物主要参与了mRNA剪接和翻译的RNA结合蛋白(RBP),并且这些RBP含有高度富集的精氨酸甲基化区域。此外,该研究证实抑制PRMT活性可以广泛地改变可变剪接并抑制翻译。值得一提的是,研究发现核糖体蛋白含有大量的精氨酸甲基化修饰,其甲基化位点的突变抑制了核糖体组装、mRNA翻译以及细胞生长。
该研究系统性地将每个PRMT和精氨酸甲基化事件联系起来,并提供了PRMT生物学功能的新见解,揭示了精氨酸甲基化在RNA加工和翻译调控中的关键功能。研究中的新发现和数据分析方法有望引起蛋白质修饰和RNA生物学领域科研人员的兴趣,从而促进精氨酸甲基化领域的发展。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


