中美双重突破性疗法!荣昌生物维迪西妥单抗尿路上皮癌适应症上市申请获受理
来源:荣昌生物 2021-07-15 11:38
7月14日,荣昌生物维迪西妥单抗用于治疗HER2过表达局部晚期或转移性尿路上皮癌患者的新药上市申请,正式获国家药监局受理。这是继上个月首个适应症获批上市销售之后,维迪西妥单抗迎来的又一重磅消息。在此之前,这款中国自主研发的首个ADC新药,已先后获得美国药监局和中国药监局授予的突破性疗法认证,成为首个拿到美、中两国突破性疗法双重认定的ADC药物,也
7月14日,荣昌生物维迪西妥单抗用于治疗HER2过表达局部晚期或转移性尿路上皮癌患者的新药上市申请,正式获国家药监局受理。这是继上个月首个适应症获批上市销售之后,维迪西妥单抗迎来的又一重磅消息。
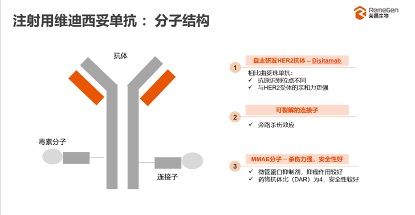
尿路上皮癌是世界范围内排名第九的常见恶性肿瘤,其发病率及死亡率均占男性泌尿生殖系统肿瘤的首位,且逐年上升。根据弗若斯特沙利文报告,全球新增尿路上皮癌病例于 2030 年将达到约 66.2 万例,2025 年至 2030 年复合年增长率为 2.5%;在中国,尿路上皮癌的发病率增速高于全球水平,预计于2030年将达到约 10.6 万例。统计显示,该病复发率和转移率较高,约20%的患者确诊时已发生转移或病程已进展至不可切除阶段,现有治疗手段远未满足巨大的临床需求。
维迪西妥单抗是中国第一个提交上市申请的靶向HER2治疗尿路上皮癌的ADC药物。今年6月,全球最权威肿瘤学术盛会ASCO年会召开,荣昌生物亮相盛会的最新研究显示,维迪西妥单抗对经过二线及以上系统化疗的尿路上皮癌适应症患者均有突出疗效和生存获益,独立影像学评估的客观有效率达到50%,中位无进展生存时间为5.1个月,中位生存时间为14.2个月;联合PD-1单抗治疗一线转移性尿路上皮癌疗效惊人,在HER2有表达的病人中,客观缓解率达到100%,有望实现尿路上皮癌一线治疗的重大突破。

在尿路上皮癌适应症递交上市申请之前,维迪西妥单抗首个适应症已于今年 6 月 9日获国家药监局( NMPA)批准上市销售,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。维迪西妥单抗获批,打破了ADC药物领域无原创国产新药的局面,填补了全球HER2过表达胃癌患者后线治疗的空白,是我国自主创新生物药发展史上的一个里程碑。 (生物谷 bioon)
在此之前,这款中国自主研发的首个ADC新药,已先后获得美国药监局和中国药监局授予的突破性疗法认证,成为首个拿到美、中两国突破性疗法双重认定的ADC药物,也是至今唯一一个拿到FDA突破性疗法认定的囯产ADC药物,而获认定的正是尿路上皮癌适应症。

尿路上皮癌是世界范围内排名第九的常见恶性肿瘤,其发病率及死亡率均占男性泌尿生殖系统肿瘤的首位,且逐年上升。根据弗若斯特沙利文报告,全球新增尿路上皮癌病例于 2030 年将达到约 66.2 万例,2025 年至 2030 年复合年增长率为 2.5%;在中国,尿路上皮癌的发病率增速高于全球水平,预计于2030年将达到约 10.6 万例。统计显示,该病复发率和转移率较高,约20%的患者确诊时已发生转移或病程已进展至不可切除阶段,现有治疗手段远未满足巨大的临床需求。
维迪西妥单抗是中国第一个提交上市申请的靶向HER2治疗尿路上皮癌的ADC药物。今年6月,全球最权威肿瘤学术盛会ASCO年会召开,荣昌生物亮相盛会的最新研究显示,维迪西妥单抗对经过二线及以上系统化疗的尿路上皮癌适应症患者均有突出疗效和生存获益,独立影像学评估的客观有效率达到50%,中位无进展生存时间为5.1个月,中位生存时间为14.2个月;联合PD-1单抗治疗一线转移性尿路上皮癌疗效惊人,在HER2有表达的病人中,客观缓解率达到100%,有望实现尿路上皮癌一线治疗的重大突破。

在尿路上皮癌适应症递交上市申请之前,维迪西妥单抗首个适应症已于今年 6 月 9日获国家药监局( NMPA)批准上市销售,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。维迪西妥单抗获批,打破了ADC药物领域无原创国产新药的局面,填补了全球HER2过表达胃癌患者后线治疗的空白,是我国自主创新生物药发展史上的一个里程碑。 (生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


