诺奖得主公司带来证据:体内基因编辑疗法安全且有效
来源:生物探索 2021-06-29 12:45
Intellia Therapeutics公司以及再生元公司在新英格兰医学杂志(NJEM)公布了由双方合作研发的体内基因编辑候选药物NTLA-2001的 1 期临床试验的中期数据,显示在遗传性转甲状腺素蛋白淀粉样(ATTR )变性伴多发性神经病(ATTRv-PN)患者中,单剂NTLA-2001能够将患者血清中的转甲状腺素蛋白水平(TT
Intellia Therapeutics公司以及再生元公司在新英格兰医学杂志(NJEM)公布了由双方合作研发的体内基因编辑候选药物NTLA-2001的 1 期临床试验的中期数据,显示在遗传性转甲状腺素蛋白淀粉样(ATTR )变性伴多发性神经病(ATTRv-PN)患者中,单剂NTLA-2001能够将患者血清中的转甲状腺素蛋白水平(TTR)平均下降87%,在第28天最高降幅可达96%。
根据Intellia Therapeutics公司发布的新闻稿,这是首个支持体内CRISPR 基因编辑安全性和有效性的临床数据,而NTLA-2001则有望成为 ATTR 淀粉样变性疾病的首个治愈性治疗方法。
值得注意的是,Intellia Therapeutics公司的联合创始人之一为CRISPR基因编辑系统的先驱之一Jennifer Doudna教授。由于在基因编辑领域的贡献, Doudna教授在去年被授予了诺贝尔化学奖。
转甲状腺素蛋白淀粉样变性(ATTR)是一种罕见的、进行性加重并可致命的疾病,通常影响心脏或神经。全球约有5万名ATTR患者,大部分患者从出现症状起预期生命仅为2-15年。
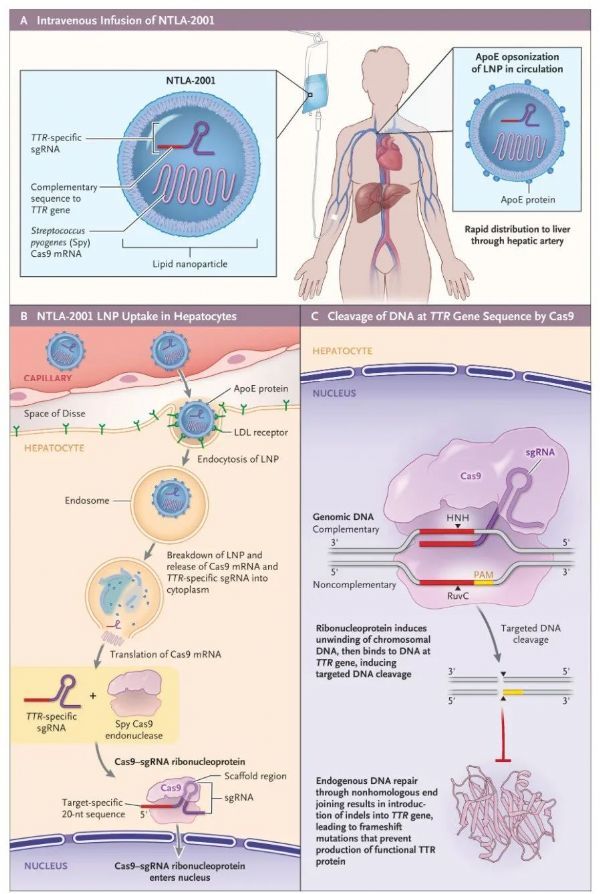
NTLA-2001是第一个通过静脉注射的基于CRISPR/Cas9的候选疗法,通过脂质纳米颗粒(LNP),包装靶向TTR基因的CRISPR基因编辑系统。目前Intellia Therapeutics正在开展关于NTLA-2001治疗ATTRv-PN的全球1期试验,预计将纳入38名18-80岁的目标患者,以评估NTLA-2001的安全性、耐受性以及药代动力学和药效学情况。
据悉,此次公布的中期分析数据涵盖6名正在接受NTLA-2001治疗的ATTR患者,分为两组接受0.1 mg/kg和0.3 mg/kg剂量的NTLA-2001治疗。在接受NTLA-2001治疗第28天后,患者血清TTR的水平表现出依赖性降低,0.1 mg/kg剂量组的患者平均降低52%,0.3 mg/kg剂量组平均降低了87%,并且较大剂量组有一名患者的TTR水平甚至降低了96%,而标准治疗则往往带来约80%的TTR降低效果。
在安全性方面,接受NTLA-2001治疗的6名患者表现出良好的耐受性,到治疗的第28天均未发生严重的不良反应和肝脏受损情况。
Intellia Therapeutics公司总裁兼首席执行官John Leonard博士说:“这项史无前例的临床数据表明,基于静脉输注CRISPR从而精确地编辑人体内的靶细胞、治疗遗传性疾病是可能的。NTLA-2001有望成为阻止和逆转ATTR疾病的潜力,这为治疗其他遗传疾病打开了大门,同时也开启了真正的医学新纪元。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。