Hepatology:低氧诱导的外泌体促进大肠癌肝转移
来源:本站原创 2021-06-17 09:54
肝转移是结直肠癌患者的常见病,15%-25%的结直肠癌患者在初诊时就有肝转移。具体地说,一些症状较轻的区域性患者(Ⅰ期或II期)也会迅速进展为肝转移,甚至及时切除原位结直肠癌病灶。然而,肝转移的确切机制仍不清楚。本文研究显示低氧诱导的外泌体miR-135a-5p与大肠癌转移灶内肝转移的发生、临床严重程度及预后密切相关,提示miR-135a-5p可能是阻止大肠
肝转移是结直肠癌患者的常见病,15%-25%的结直肠癌患者在初诊时就有肝转移。具体地说,一些症状较轻的区域性患者(Ⅰ期或II期)也会迅速进展为肝转移,甚至及时切除原位结直肠癌病灶。然而,肝转移的确切机制仍不清楚。本文研究显示低氧诱导的外泌体miR-135a-5p与大肠癌转移灶内肝转移的发生、临床严重程度及预后密切相关,提示miR-135a-5p可能是阻止大肠癌肝转移的有效靶点。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34110633/
肝脏是结直肠癌(CRC)转移最常见的靶点之一。大肠癌合并肝转移患者的5年相对生存率为3.3%,明显低于区域期结直肠癌患者的5年期相对生存率(90.3%)。有趣的是,肝转移不仅发生在晚期患者,也发生在及时切除原位病变的患者中。因此,嗜肝转移是大肠癌预后和治疗面临的主要挑战之一。然而,肝转移的确切分子机制仍不清楚。
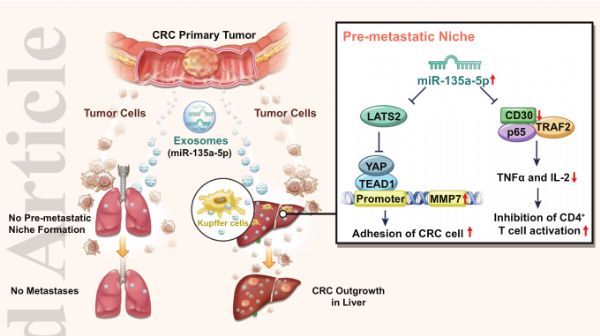
转移前生态位是促进肿瘤转移的关键因素,因为它为肿瘤细胞在远端组织中的扩散提供了支持和接受的微环境,包括器官亲和性、血管通透性、炎症和免疫抑制等。此外,肿瘤转移前生态位形成的几个参与者对肿瘤转移的诊断、预后预测和介入治疗具有重要价值。一些研究已经对转移前生态位的形成机制进行了研究,其中外泌体是近年来最受关注的研究。据报道,胰腺癌来源的外泌体具有高表达的巨噬细胞迁移抑制因子,并能在肝脏中启动转移前生态位的形成。结直肠癌细胞分泌的外体miR-25-3p可引起血管渗漏,促进结直肠癌多器官转移。外泌体是起源于多囊泡(MVB)的小膜泡(70-120 nm)。它们在MVB与细胞膜融合后释放到细胞外环境中。肿瘤来源的外切体稳定地存在于血液循环中,并通过传递几种嵌入的功能成分(蛋白质和核酸)来促进原发肿瘤和远处器官之间的沟通。一些研究表明,在癌症转移发生之前,原发肿瘤释放的外泌体可能通过外切体包装的蛋白和microRNAs(MiRNAs)启动转移前的生态位并调节器官嗜性以促进转移的发展。MiRNAs是一类小的非编码RNA,在转录和翻译水平上调节靶基因的表达。据报道,它们在结直肠癌中通过调节不同的信号通路发挥癌基因或肿瘤抑制因子的作用。在本研究中,作者发现外泌体miR-135a-5p对大肠癌的肝脏器质性转移有一定的治疗作用。
总结研究结果的示意图
图片来源:https://pubmed.ncbi.nlm.nih.gov/34110633/
总之,作者的研究表明,原发性大肠癌的低氧微环境促进了含有miR-135a-5p的外泌体的释放,这启动了肝脏转移前的生态位,从而控制了大肠癌的亲肝转移。提示外体miR-135a-5p可预测大肠癌患者的预后,可作为预防大肠癌肝转移的一种潜在策略。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。