银屑病关节炎(PsA)新药!艾伯维口服JAK1抑制剂Rinvoq治疗一年以上(56周):持续改善疾病活动!
来源:本站原创 2021-06-04 03:50
JAK1是一种激酶,在多种炎症性疾病的病理生理过程中发挥了关键作用。

2021年06月04日讯 /生物谷BIOON/ --艾伯维(AbbVie)近日在2021年欧洲风湿病学年会(EULAR2021)上公布了口服抗炎药Rinvoq(upadacitinib)治疗活动性银屑病关节炎(PsA)3期SELECT-PsA 2试验的分析结果。数据显示,在对一种或多种生物类疾病修饰抗风湿药物应答不足(bDMARD-IR)的活动性PsA患者中,Rinvoq(15mg,每日一次)持续治疗导致疾病活动持续改善。在第56周,有29%的患者实现最低疾病活动(MDA)。
Rinvoq是一种口服、每日一次、选择性、可逆性JAK抑制剂,在美国已被批准用于治疗类风湿性关节炎(RA),在欧盟已被批准用于治疗3种成人风湿适应症:RA、PsA、强直性脊柱炎(AS)。
在SELECT-PsA 2试验中,治疗第56周,接受Rinvoq(15mg,每日一次)持续治疗的患者中,有60%达到ACR20反应。此外,41%/24%的患者分别达到ACR50/ACR70反应。此外,在持续接受Rinvoq 15mg治疗的患者中,达到附着点炎和指关节炎消退、皮损清除较基线改善(通过PASI 75/90/100测量)的患者比例保持不变。
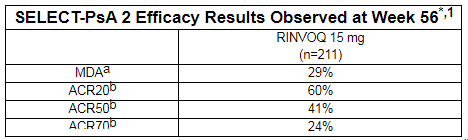
SELECT-PsA 2试验56周结果
之前曾报道过在第24周Rinvoq 15mg的安全性结果,与类风湿性关节炎临床试验项目中观察到的结果一致,未发现新的重大安全风险。在第56周,Rinvoq 15mg组的严重感染发生率为2.6次/100患者年(PY)。主要不良心血管事件发生率为0.2次/100PY,静脉血栓栓塞事件发生率为0.2次/100PY。Rinvoq 15mg组在56周内无死亡报告。
艾伯维全球医疗事务风湿病学负责人Mudra Kapoor医学博士表示:“我们很高兴与大家分享这些结果,数据表明Rinvoq治疗银屑病关节炎在各种肌肉骨骼和皮肤症状方面随着时间的推移都有持续改善。在欧盟最近批准Rinvoq治疗银屑病关节炎的基础上,这些结果进一步加强了Rinvoq在提供足够的疾病控制方面所起的关键作用,随着时间的推移,银屑病关节炎多种体征和症状的改善继续维持。”
瑞典医学中心/普罗维登斯圣约瑟夫医疗中心风湿病研究部主任Philip Mease医学博士表示:“由于持续的肌肉骨骼和皮肤症状,银屑病关节炎的治疗可能很复杂,经常会导致疼痛和身体功能丧失。这些数据表明,Rinvoq能够维持银屑病关节炎症状改善超过一年,没有新的重大安全信号。Rinvoq是一种重要的治疗选择,可以帮助风湿病学家为患者提供长期维持疾病活动改善的服务。”
银屑病关节炎(图片来源:onhealth.com)
SELECT-PsA 2(NCT03104374)是一项多中心、随机、双盲、平行组、安慰剂对照3期研究,在对至少一种生物疾病修饰抗风湿药物应答不足(bDMARD-IR)的活动性PsA患者中开展,旨在评估Rinvoq相对于安慰剂的疗效和安全性。研究中,患者随机分配接受Rinvoq 15mg、Rinvoq 30mg、安慰剂治疗,在第24周时口服Rinvoq 15mg或Rinvoq 30mg。
研究的主要终点是在治疗12周后达到ACR20反应的患者百分比,次要终点包括健康评估问卷残疾指数(HAQ-DI) 相对基线的变化、患者在第12周达到ACR50和ACR70的比例、患者在第16周达到PASI 75的比例以及患者在第24周达到最低疾病活动度(MDA)的比例。该试验正在进行中,长期扩展试验仍然封盲,以评估2种每日一次剂量(15mg和30mg)Rinvoq在已完成安慰剂对照期的患者中的长期安全性、耐受性和疗效。
艾伯维先前公布了来自SELECT-PsA 2试验的12周顶线结果,数据显示:与安慰剂相比,2种剂量Rinvoq(15mg和30mg,每日一次)均达到了ACR20反应的主要终点和所有关键的次要终点。详细数据如下:
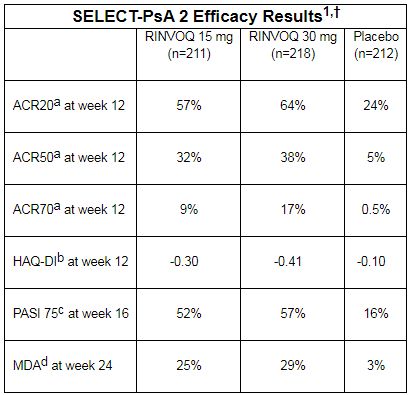
SELECT-PsA 2试验12周顶线结果
Rinvoq的活性药物成分为upadacitinib,这是由艾伯维发现和开发的一种口服选择性和可逆的JAK1抑制剂,正被开发治疗数种免疫介导的炎症性疾病。JAK1是一种激酶,在多种炎症性疾病的病理生理过程中发挥了关键作用。
Rinvoq于2019年8月在美国获得全球首个监管批准,用于治疗对甲氨蝶呤(MTX)应答不足或不耐受的中度至重度活动性类风湿性关节炎(RA)成人患者。在欧盟,Rinvoq于2019年12月获批上市,目前已批准的适应症包括:(1)用于治疗对一种或多种疾病修饰抗风湿药物(DMARD)应答不足或不耐受的中度至重度RA成人患者;(2)用于治疗对一种或多种DMARD应答不足或不耐受的活动性PsA成人患者;(2)用于治疗对常规疗法应答不足的活动性强直性脊柱炎(AS)成人患者。
目前,Rinvoq治疗溃疡性结肠炎(UC)、类风湿性关节炎(RA)、银屑病关节炎(PsA)、中轴型脊柱关节炎(axSpA)、克罗恩病(CD)、特应性皮炎(AD)、巨细胞动脉炎(GCA)的III期临床研究正在进行中。
业界对Rinvoq的商业前景非常看好。瑞银集团分析师此前预测,Rinvoq与艾伯维的另一款单抗抗炎药Skyrizi,销售峰值将达到110亿美元。这2款新产品,将能够弥补艾伯维旗舰产品Humira(修美乐,阿达木单抗)遭遇生物仿制药冲击带来的销售损失。
Humira是全球第一个获批的抗肿瘤坏死因子α(TNF-α)药物,也是全球最畅销的抗炎药,2020年的全球销售额接近200亿美元(198.32亿美元)。在欧盟,已有多款阿达木单抗生物仿制药上市销售。而在美国市场,Humira将在2023年受到生物仿制药冲击。(生物谷Bioon.com)
原文出处:AbbVie to Present Analysis Evaluating Continuous RINVOQ® (upadacitinib) Treatment in Psoriatic Arthritis for More Than One Year at EULAR 2021 Virtual Congress
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


