PNAS报道新型腺病毒递送系统:瘤内抗体水平比直接给药提高21倍
来源:医药魔方 2021-05-23 16:25
肿瘤靶向疗法有两大难题:脱靶毒性和实体瘤穿透。例如抗体通常是静脉内递送,并且需要多次重复给药才能获得足够的水平,从而在肿瘤中发挥作用,而健康组织如果暴露在相似的药物水平中则可能会发生药物副作用。相比于直接注射给药,能使药物在原位扩散并在局部作用的递送方式显然更有吸引力。在线发表于PNAS上的一篇最新研究中,瑞士苏黎世大学的研究人员利用改良腺病毒(一种常见的呼
肿瘤靶向疗法有两大难题:脱靶毒性和实体瘤穿透。例如抗体通常是静脉内递送,并且需要多次重复给药才能获得足够的水平,从而在肿瘤中发挥作用,而健康组织如果暴露在相似的药物水平中则可能会发生药物副作用。
相比于直接注射给药,能使药物在原位扩散并在局部作用的递送方式显然更有吸引力。
在线发表于PNAS上的一篇最新研究中,瑞士苏黎世大学的研究人员利用改良腺病毒(一种常见的呼吸道病毒)将治疗性基因递送到肿瘤细胞中,通过在肿瘤细胞内产生抗体,实现由内而外杀伤肿瘤。
SHREAD递送系统
研究人员设计了一个基于腺病毒血清型5(Ad5)的SHREAD(SHielded, REtargeted ADenovirus)基因治疗平台,SHREAD可根据选定的表面标记物(本研究中为HER2)靶向特定细胞,并将靶细胞转化为分泌治疗物质的生物工厂,而且SHREAD使用了基于抗体三聚体单链可变片段(scFv)的防护罩,可大大降低肝脏嗜性,还能使其免受免疫系统的清除作用。
利用这一平台,研究人员诱导肿瘤细胞表达抗癌药杀灭自身,这些治疗物质大部分停留在治疗位置,肿瘤微环境中的药物浓度更高,而扩散到全身循环中的剂量要低得多,从而减少了对健康器官和组织的损害。
可视化消灭肿瘤
在概念验证研究中,SHREAD系统使小鼠的HER2过表达乳腺肿瘤中产生了曲妥珠单抗,而且与直接注射曲妥珠单抗相比,SHREAD在肿瘤中产生的抗体量更多。
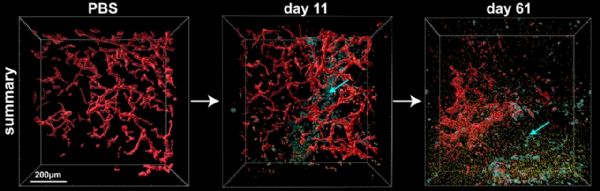
研究人员使用了高分辨率3D成像技术使组织呈完全透明,证明了SHREAD高水平的肿瘤细胞特异性转导和显着且持久的抗体产生。此外,SHREAD可以显着降低血液和其它组织中抗体的浓度,从而降低发生副作用的可能。
利用这一技术,研究人员对分泌的抗体进行了局部量化,并直接观察到了肿瘤中孔的形成发生增强以及完整脉管系统的破坏,而且在治疗第11天,与直接给药相比,抗体的原位产生使得肿瘤中测得的曲妥珠单抗高了21倍,血浆中的曲妥珠单抗低了89倍,肝脏中的曲妥珠单抗低了2.2倍。
不只是肿瘤治疗
由于SHREAD系统可使健康组织不再接触大量药物,因此,SHREAD不仅可以应用在抗癌中,也可用于递送各类生物制剂。研究小组目前正在将SHREAD应用于COVID-19治疗项目中。
论文通讯作者Sheena Smith博士解释说:“通过吸入气雾剂将SHREAD递送给患者,可以在肺细胞中定向产生COVID抗体。这种方法将降低疗法成本,增加COVID疗法的可及性,而且疫苗的递送也能通过吸入方法进行改良。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->