蛋白质N-端选择性仿生转氨化合成抗HIV药物研究取得进展
来源:昆明动物研究所 2021-05-11 12:21
蛋白质的定点修饰是通过化学反应对蛋白质特定位点进行修饰,从而达到对蛋白质改性或对其进行标记等一系列目的。蛋白质的定点修饰对反应条件严格:反应需在水相溶液中进行,同时蛋白质其它侧链基团不参与反应。近日,上海交通大学特别研究员王平课题组与中国科学院昆明动物研究所研究员郑永唐课题组合作,发展了一种由仿生的邻醌介导对蛋白N-端进行选择性修饰的
蛋白质的定点修饰是通过化学反应对蛋白质特定位点进行修饰,从而达到对蛋白质改性或对其进行标记等一系列目的。蛋白质的定点修饰对反应条件严格:反应需在水相溶液中进行,同时蛋白质其它侧链基团不参与反应。近日,上海交通大学特别研究员王平课题组与中国科学院昆明动物研究所研究员郑永唐课题组合作,发展了一种由仿生的邻醌介导对蛋白N-端进行选择性修饰的方法,并将其运用于蛋白质标记和抗HIV药物研发等领域。
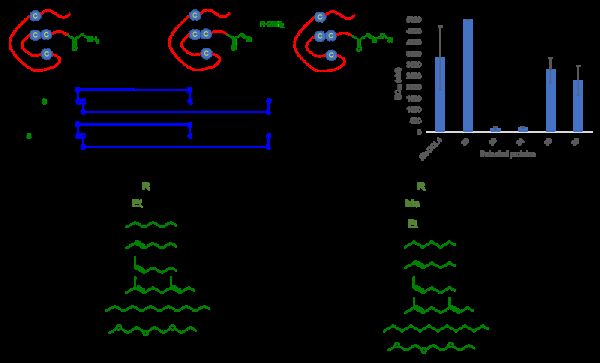
蛋白质的N-端-α胺基相较于赖氨酸的ε胺基有较低的pKa,因而更具有亲核性,是蛋白质定点修饰的理想位点。自然界中,铜胺氧化酶催化酪氨酸的侧链酚基被氧化成邻醌,邻醌可将体系内的一级胺氧化成醛、酮基。受此启发,科研人员发展了蛋白质仿生转氨化的方法。通过筛选多种邻醌类化合物与模板肽进行反应,发现邻醌试剂在pH 6.5的缓冲水溶液中具有最高活性,能在2小时内将N-端为甘氨酸的模板肽8转换为醛,随后与乙氧基胺作用产生更稳定的肟产物9,两步总转换率达到91%,而模板肽中的赖氨酸ε胺基在该反应条件下产生的副反应低于1%。该氧化条件适用于N-端为精氨酸、亮氨酸,赖氨酸,甲硫氨酸、谷氨酸,天门冬氨酸、丝氨酸、苏氨酸、色氨酸和天门冬酰胺等多肽的修饰,均能以高产率获得修饰多肽。
随后,该方法被应用于蛋白质目标物泛素及肌红蛋白的修饰,均能以70%以上的转化率得到目标肟产物及生物素标记的肌红蛋白修饰产物。由于反应条件对蛋白序列中游离的半胱氨酸巯基并不耐受,科研人员进而发展了光敏保护基策略,即先将蛋白质中游离的半胱氨酸与小分子2-硝基胡椒苄溴反应而被选择性保护,随后进行转胺化反应,最后通过光解脱除保护基,即得到目标修饰蛋白质。反应过程中不需额外分离手段,只需通过简单萃取去除小分子反应物即可,最大限度地维持了蛋白质的三级结构。科研人员将该策略应用于含游离半胱氨酸的SUMO2和RNF4蛋白质的转胺化。
蛋白质趋化因子CCL4是HIV辅助受体CCR5的配体。科研人员利用该策略对CCL4的N-端进行转胺化修饰,快速得到一系列修饰蛋白质29-45。抗HIV-1活性体外实验表明,带修饰蛋白质30和31的抗HIV-1活性相较于表达的CCL4活性有显着提高。该实验表明,通过蛋白质化学合成与定点修饰联用可以在短时间内得到大量不同修饰的蛋白质,可为抗HIV蛋白质类药物的制备提供技术手段。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


