国产PD-1疗法!君实生物特瑞普利单抗(拓益®)一线治疗食管癌3期临床获得成功!
来源:本站原创 2021-04-24 02:36
截至目前,已有2款PD-(L)1被批准治疗食管癌。在中国,Keytruda是第一个治疗食管癌的免疫疗法。

2021年04月23日讯 /生物谷BIOON/ --君实生物(Junshi Biosciences)近日宣布,其自主研发的抗PD-1单抗药物特瑞普利单抗注射液(拓益®,toripalimab)联合化疗一线治疗晚期食管鳞癌(ESCC)的随机、双盲、安慰剂对照、多中心的3期临床研究(JUPITER-06研究,clinicaltrials.gov标识符:NCT03829969)在期中分析中,由独立数据监察委员会(IDMC)判定2个主要研究终点无进展生存期(PFS)和总生存期(OS)都达到方案预设的优效界值。君实生物将于近期内与监管部门沟通递交上市申请事宜。
食管癌是一种原发于食管黏膜上皮的恶性肿瘤,是全球高发肿瘤之一。相关数据显示,2020年,食管癌为全球第七大常见恶性肿瘤和第六大癌症死亡原因。其中,中国的食管癌新发病例约32万,死亡约30万,发病率和死亡率分别位居所有恶性肿瘤中第五和第四位。
食管鳞癌和腺癌是食管癌的2种主要组织学亚型,其中中国患者以食管鳞癌为主要亚型,约占总体发病率的90%。对于晚期食管鳞癌患者,目前标准一线化疗方案为铂类为基础的化疗,但5年总生存率仍小于20%。国内外研究表明,抗PD-1单抗药物联合化疗有望成为食管鳞癌的新一线标准治疗。
食管癌(图片来源:medindia.net)
JUPITER-06研究(NCT03829969)是一项随机、双盲、安慰剂对照、多中心的3期临床研究,旨在比较特瑞普利单抗联合紫杉醇/顺铂与安慰剂联合紫杉醇/顺铂在晚期食管鳞癌的一线治疗的疗效和安全性。根据JUPITER-06研究期中分析结果,独立数据监察委员会(IDMC)判定该研究两个主要研究终点无进展生存期(PFS)和总生存期(OS)都达到方案预设的优效界值,结果表明特瑞普利单抗注射液联合紫杉醇/顺铂一线治疗晚期食管鳞癌患者,较紫杉醇/顺铂的标准一线治疗,可显著延长患者的无进展生存期和总生存期。关于详细的研究数据,君实生物将在近期的国际学术大会上公布。
特瑞普利单抗是一款重组人源化抗PD-1单克隆抗体注射液,拥有独特的双重作用机制。该药属于PD-(L)1肿瘤免疫疗法,这类疗法旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力。
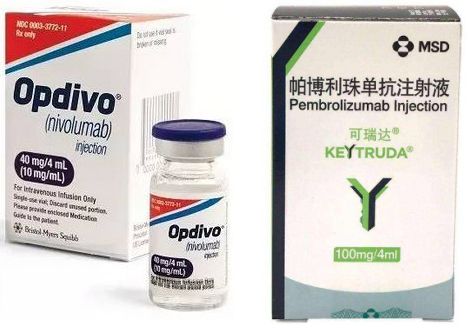
在全球范围内,目前已有12款PD-(L)1疗法获得批准,其中已有8款在中国获批。食管癌免疫治疗方面,已有2款PD-1疗法获得批准,分别为默沙东抗PD-1疗法Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗)和百时美施贵宝抗PD-1疗法Opdivo(欧狄沃,纳武利尤单抗)。
其中,Keytruda适用于治疗肿瘤表达PD-L1(合并阳性评分[CPS]≥10)、接受一种或多种系统疗法后疾病进展的复发性、局部晚期或转移性食管鳞状细胞癌(ESCC)患者。Opdivo适用于治疗接受化疗后病情进展的不可切除性晚期或复发性ESCC患者,不论PD-L1状态如何。
在中国,Keytruda于2020年6月获得国家药监局批准,作为单药疗法,用于治疗先前系统疗法治疗失败、肿瘤表达PD-L1(合并阳性评分[CPS]≥10)的局部晚期或转移性食管鳞状细胞癌(ESCC)患者。这一新的适应症是根据全球III期KEYNOTE-181试验的总生存期(OS)结果获得完全批准,包括在中国患者中的扩展数据。(生物谷Bioon.com)
原文出处:君实生物、生物谷
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


