Cell:新研究表明TOP1抑制疗法可阻止新冠病毒诱导的致命炎症
来源:本站原创 2021-04-06 13:04
2021年4月6日讯/生物谷BIOON/---目前,由SARS-CoV-2冠状病毒引起的COVID-19大流行正在影响全球数百万人的生命,并对全球卫生系统和经济造成巨大负担。开发抗SARS-CoV-2的新疗法仍然是当务之急。在评估和分发预防措施的同时,迫切需要开发靶向SARS-CoV-2和具有治疗作用的药物,特别是针对COVID-19重症病例。大型回顾性研究
2021年4月6日讯/生物谷BIOON/---目前,由SARS-CoV-2冠状病毒引起的COVID-19大流行正在影响全球数百万人的生命,并对全球卫生系统和经济造成巨大负担。开发抗SARS-CoV-2的新疗法仍然是当务之急。在评估和分发预防措施的同时,迫切需要开发靶向SARS-CoV-2和具有治疗作用的药物,特别是针对COVID-19重症病例。大型回顾性研究表明,炎性细胞因子和促炎因子水平的升高与疾病严重程度和死亡率的增加有关。
减少感染时基因表达的诱导程度可能是开发针对与过度炎症相关的感染的新疗法的关键。为了了解SARS-CoV-2在感染过程中如何改变染色质功能和基因活性,在一项新的研究中,来自美国西奈山伊坎医学院等研究机构的研究人员在感染过程中进行了结构和表观遗传学的结合分析。相关研究结果于2021年3月30日在线发表在Cell期刊上,论文标题为“TOP1 inhibition therapy protects against SARS-CoV-2-induced lethal inflammation”。

这些作者对表达人ACE2受体的A549细胞(下称A549-ACE2细胞)在感染SARS-CoV-2后的早期(8h)和晚期(24h)以及在未感染时进行Hi-C分析,结果发现随着感染的发展,细胞基因组的大部分改变它们的全局性相互作用图谱,最终在感染后的24h时间点上与活性(A)或非活性(B)区室相关的染色质发生较大的重新分配。他们还发现这种感染激活的宿主基因大多数是炎症性的。
他们随后发现拓扑异构酶I(TOP1)控制SARS-CoV-2诱导的基因表达反应。他们在A549-ACE2细胞中进行siRNA介导的TOP1敲降,TOP1敲降后的细胞对这种病毒表现出明显的转录反应,从而导致很多感染诱导的基因遭受选择性抑制。对TOP1敲降后下调的基因进行分析表明其中的很多基因参与炎症反应。进一步的实验表明剔除TOP1降低炎症基因IL-6、CXCL2、CXCL3、CXCL8、EGR1和TNFAIP3的表达。此外,利用一种获得美国食品药品管理局(FDA)批准的TOP1抑制剂---拓扑替康(topotecan, TPT)---处理感染SARS-CoV-2的A549-ACE2细胞,结果发现与利用siRNA进行TOP1敲降一样,TPT处理抑制IL-6、CXCL2、CXCL3、CXCL8、EGR1和TNFAIP3表达。不过与具有抗病毒活性的瑞德西韦不同的是,TPT并不抑制病毒复制,这表明它的活性在于抑制宿主基因表达。
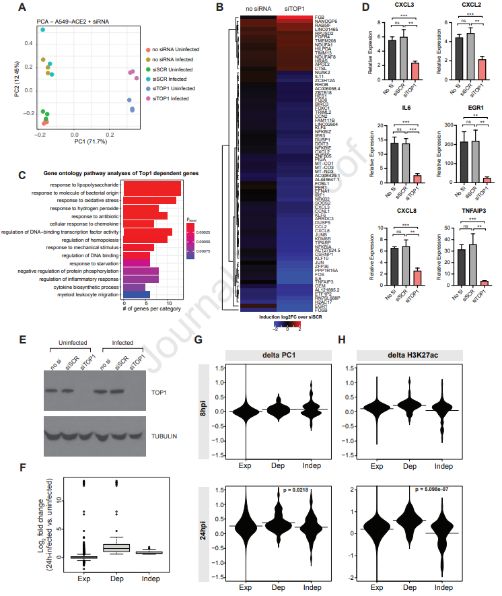
剔除SARS-CoV-2感染的细胞中的TOP1 抑制炎症基因表达。图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.051。
接着,这些作者在叙利亚金黄地鼠感染SARS-CoV-2后第一天和第二天,分别用TPT(10mg/kg)和二甲基亚砜(DMSO,作为对照)处理这些地鼠。在感染后第4天和第6天对来自这些地鼠的肺部进行组织学和转录组分析。他们发现TPT抑制受感染地鼠肺部中的炎症基因表达,而且接受TPT处理的受感染地鼠肺部的基因表达谱类似于未受感染地鼠肺部。不同于二甲基亚砜处理的那样,TPT处理减少受感染地鼠中肺部损伤的病理特征,而且感染后第4天和第6天,它们的肺部没有明显的肺泡腔浸润、渗出或出血。此外,当将TPT剂量下降5倍至2mg/kg时,在SARS-CoV-2感染期间,TPT处理仍然能有效地抑制受感染地鼠中的炎症基因表达,缓解炎症诱导的病理特征。这一结果支持以下假设:TPT在体内抑制SARS-CoV-2诱导的肺部炎症。
为了测试抑制炎症是否会给感染SARS-CoV-2的K18-hACE2小鼠提供保护效果,这些作者开展三种不同的TPT处理方案:早期方案,在感染后第一天和第二天给送2mg/kg TPT;中期方案,在感染后第三天和第四天给送2mg/kg TPT;晚期方案,感染后第四天和第五天给送2mg/kg TPT。他们的结果表明早期方案和中期方案不能有效地降低SARS-CoV-2 感染引起的发病率和死亡率,尽管中期方案显著地延迟体重减轻的发生。而晚期方案给受感染小鼠提供显著的生存获益,而且显著改善受感染小鼠的发病率。正如预期的那样,TPT处理与受感染小鼠肺部的炎症基因表达遭受抑制相关。
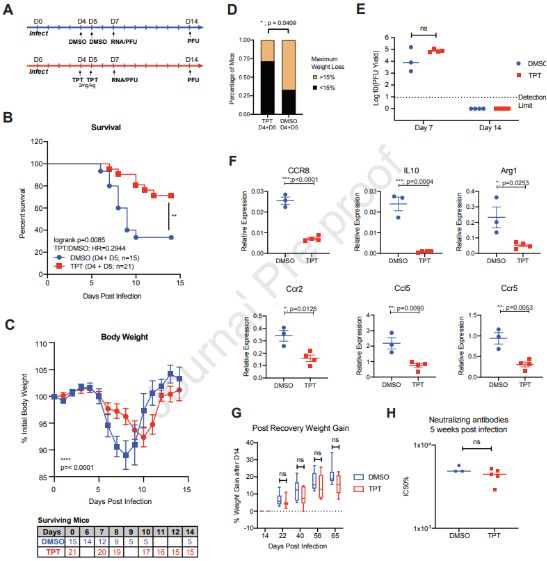
在SARS-CoV-2感染期间,晚期TPT处理给K18-hACE2小鼠提供生存获益。图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.051。
他们在受感染的K18-hACE2小鼠中评估了TPT处理的长期影响。相比于DMSO处理的小鼠,TPT处理的小鼠在感染后存活了9周。DMSO处理的小鼠和TPT处理的小鼠在感染后5周具有类似的中和抗体活性,这表明TPT处理并不会负面地影响适应性免疫反应。这表明TPT处理抑制这些受感染小鼠的高炎症反应可以使其摆脱SARS-CoV-2的致命感染。
综上所述,这些结果支持TOP1抑制有潜力作为一种有效地对抗严重SARS-CoV-2感染的宿主靶向疗法。TPT及其衍生物是大多数国家可获得的廉价的临床级抑制剂。还需要开展临床试验来评估重新利用TOP1抑制剂治疗人类重症COVID-19的疗效。(生物谷 Bioon.com)
参考资料:
Jessica Sook Yuin Ho et al. TOP1 inhibition therapy protects against SARS-CoV-2-induced lethal inflammation. Cell, 2021, doi:10.1016/j.cell.2021.03.051.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


