Mol Cell:光敏性sgRNA调控Cas9蛋白的失活
来源:本站原创 2021-04-03 05:17
对CRISPR-Cas9技术的精确调控可以提高其在基因编辑方面的安全性和适用性,然而这一目标目前却仍受 “不完全失活” 、 “速率过慢” 等缺点的限制。为了克服这些障碍,在最近一项研究中,来自约翰霍普金斯大学的Taekjip Ha教授等人设计了光敏感、可裂解的guide RNA(pcRNA),从而能够利用光照达到降解sgRNA分子,进而调控Cas9核酸酶基因
2021年4月3日讯/生物谷BIOON/---对CRISPR-Cas9技术的精确调控可以提高其在基因编辑方面的安全性和适用性,然而这一目标目前却仍受 “不完全失活” 、 “速率过慢” 等缺点的限制。为了克服这些障碍,在最近一项研究中,来自约翰霍普金斯大学的Taekjip Ha教授等人设计了光敏感、可裂解的guide RNA(pcRNA),从而能够利用光照达到降解sgRNA分子,进而调控Cas9核酸酶基因编辑活性的目的。相关结果发表在最近的《Molecular Cell》杂志上。
(图片来源:www.cell.com)
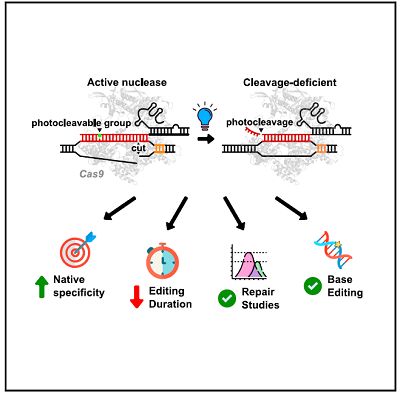
首先,作者在gRNA分子中插入了光敏可切割基团,构建出了pcRNA分子,进而在体外实验中验证了该修饰后的sgRNA是否受光照的调节。实验结果表明,在缺乏光照的情况下,pcRNA与cas9混合物能够高效地切割DNA底物。相反地,在接受350nm光照的情况下,DNA分子则几乎没有受到切割。光照30s就足以达到灭活sgDNA-cas9复合体活性的目的。此外,作者还证明了pcRNA分子同时能够兼容其它类型的CRISPC-cas9平台,例如单核酸碱基编辑。在转染了AncBE4max以及pcRNA分子的HEK293T细胞中,光照2分钟就足以起到灭活单碱基编辑活性的效果。

(图1,pcRNA精确调控cas9的切割活性)
众所周知,脱靶现象是基因组编辑技术中的难题,为了探究光敏基团修饰能否提高sgRNA-cas9靶向编辑的特异性,作者检测了基因组中VEGFA2以及HEK4等脱靶位点的胞嘧啶突变效应。结果显示,在共转染pcRNA与cas9/AncBE4max的HEK293T细胞中,脱靶位点的基因突变几率明显降低。与野生型sgRNA相比,光敏可切割的pcRNA的中靶/脱靶比例升高了2-9000倍。为了了解其背后的分子机制,作者通过体外切割实验检测了cas9/pcRNA的切割动力学特征。结果表明,在所有接受检测的靶向序列中,pcRNA的初始切割速率相比传统sgRNA明显更慢,但最终的切割速率达到相当的水平。此外,在sgRNA序列与靶向序列存在差异的情况下,传统的sgRNA仍旧能够介导高速率的切割,而pcRNA的切割速率明显更慢。这些结果表明pcRNA相比传统sgRNA具有更低的脱靶率。
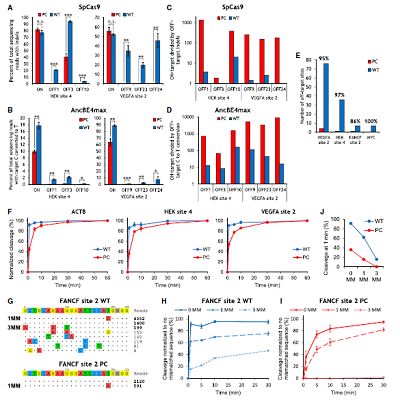
(图2,pcRNA显示更强的基因编辑特异性)
之后,作者研究了pcRNA-Cas9达到有效切割活性时所需的最低时间,作者进行了系统的动力学分析并且绘制了时间曲线。结果表明,尽管因序列差异存在较高的异质性,但对于AncBEmax而言最低时间仅需4小时,而Cas9则需要36小时。
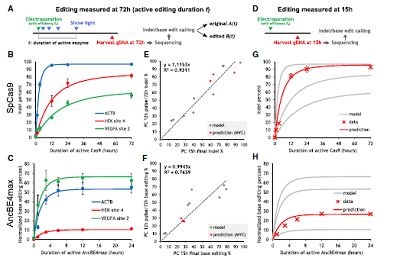

(pcRNA介导基因编辑的动力学特征)
综上,作者通过设计一种新型的“光敏性,可切割”版本的sgRNA——“pcRNA”,证明其具有相比传统sgRNA更高的特异性,更低的脱靶性以及充分的切割速率,该研究或许有助于进一步提高CRISPR-cas9基因编辑技术的潜力。(生物谷 Bioon.com)
原始出处:Roger S. Zou, Yang Liu, Bin Wu et al., Cas9 deactivation with photocleavable guide RNAs. Molecular Cell. (2021) . DOI:https://doi.org/10.1016/j.molcel.2021.02.007
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


