CDE拟突破性疗法认定 恒瑞CDK4/6 抑制剂、君实抗PD-1
来源:医药魔方 2021-03-18 12:22
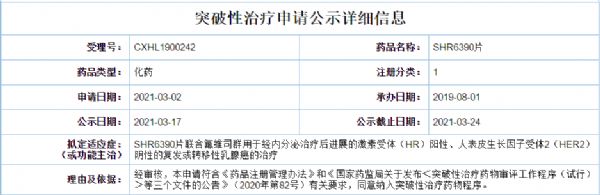
近日,CDE官网显示,恒瑞SHR6390片、君实特瑞普利单抗被CDE拟被纳入突破性疗法。恒瑞:SHR6390片SHR6390片是恒瑞研发的1类新药,是一种口服、高效、选择性的小分子 CDK4/6 抑制剂,此次拟纳入突破性疗法适应症为联合氟维司群用于经内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的复发或转
近日,CDE官网显示,恒瑞SHR6390片、君实特瑞普利单抗被CDE拟被纳入突破性疗法。
恒瑞:SHR6390片
SHR6390片是恒瑞研发的1类新药,是一种口服、高效、选择性的小分子 CDK4/6 抑制剂,此次拟纳入突破性疗法适应症为联合氟维司群用于经内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的复发或转移性乳腺癌患者的治疗。
去年12月24日,恒瑞宣布针对该项适应症的III期临床研究(SHR6390-III-301)的主要终点达到方案预设的优效标准,对于既往使用过内分泌治疗的HR阳性、HER2阴性晚期乳腺癌患者,接受SHR6390联合氟维司群对比安慰剂联合氟维司群治疗,可显着延长患者无进展生存期。
此外,恒瑞还在国内登记了SHR6390用于联合抗PD-1抗体SHR1210治疗复发性或难治性非霍奇金淋巴瘤患者,治疗CDK4扩增的经标准治疗失败的头颈黏膜恶性黑色素瘤患者,联合非甾体类芳香化酶抑制剂治疗雌激素受体阳性复发转移性卵巢癌和子宫肿瘤患者的II/III期临床研究。
目前国内辉瑞和齐鲁的哌柏西利胶囊、礼来的阿贝西利片已获批上市,恒瑞的SHR6390有望成为第3款在国内上市的CDK 4/6抑制剂。
君实:特瑞普利单抗
君实生物PD1特瑞普利单抗注射液此次拟纳入突破性疗法适应症为一线治疗晚期黏膜黑色素瘤。1月24日,该项适应症也获得了FDA授予的快速通道资格(Fast Track Designation,"FTD")认定。
值得注意的是,特瑞普利单抗第一个获批上市的适应症为治疗既往接受全身系统治疗失败后不可切除或转移性黑色素瘤,并获得了2019 年和 2020 年《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南》推荐。
2019年8月,君实公布了特瑞普利单抗联合抗血管生成药物阿昔替尼一线治疗晚期黏膜黑色素瘤开放标签IB期临床试验结果。结果显示,特瑞普利单抗联合阿昔替尼,在晚期黏膜黑色素瘤的一线治疗中客观缓解率(ORR)达48.3%(irRECIST标准:ORR为51.7%),疾病控制率(DCR)达86.2%,相较以往不超过20%的客观缓解率,结果远超预期。这一研究已发表于《临床肿瘤学杂志》。
目前特瑞普利单抗联合阿昔替尼一线治疗黏膜黑色素瘤患者的III期临床试验(IND)申请已经获得了 FDA 批准。该项临床试验是一项国际多中心、随机、开放标签的 III 期临床试验,旨在评估特瑞普利单抗联合阿昔替尼对比帕博丽珠单抗(商品名:Keytruda?), 在不可切除、局部进展或转移性黏膜黑色素瘤患者中作为一线治疗的有效性和安全性。该试验计划入组 220 名患者,以 1:1 比例随机分组。该联合用药临床试验的主要研究终点为无进展生存期(PFS),次要研究终点为客观缓解率(ORR)、 总生存期(OS)、缓解持续时间(DOR)、安全性和耐受性等。
黏膜黑色素瘤是黑色素瘤的亚型之一,其对传统化疗不敏感,对单药免疫治疗的反应率也极其有限。特瑞普利单抗是全球最早探索抗 PD-1 单抗联合 VEGFR 抑制剂在黏膜黑色素瘤中应用的 PD-1 抑制剂。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。