Mol Cell:报道TFp300共凝聚调控基因转录爆发动力学
来源:北京大学 2021-03-10 11:35
p300和它的同源基因CREB-binding protein(CBP)是转录调控过程中发挥重要作用的转录共激活因子【1】。p300/CBP的突变或者染色体易位会引起基因表达紊乱和疾病的发生【2】。前人的研究结果表明,p300/CBP至少通过两种方式来调控基因转录【3】。一方面,p300/CBP可以作为桥梁/支架来调控转录因子(TF)
p300和它的同源基因CREB-binding protein(CBP)是转录调控过程中发挥重要作用的转录共激活因子【1】。p300/CBP的突变或者染色体易位会引起基因表达紊乱和疾病的发生【2】。前人的研究结果表明,p300/CBP至少通过两种方式来调控基因转录【3】。一方面,p300/CBP可以作为桥梁/支架来调控转录因子(TF)和其它转录相关蛋白的相互作用,提高转录的协同性并且稳定转录复合物。另一方面,p300/CBP是一个乙酰化酶,可以对包括组蛋白在内的多种蛋白进行乙酰化修饰,但是它发挥功能依赖于临近的p300/CBP分子对其乙酰化从而实现反式激活【4】。一些研究的结果也表明,p300/CBP调控基因激活可以不依赖于其催化活性【5】。那么p300/CBP的这两种功能在细胞内是如何与特定的TF一起协同起来调控下游基因转录呢?
北京大学前沿交叉学科研究院定量生物学中心、北大-清华生命科学联合中心林一瀚课题组在Molecular Cell在线发表题为“Co-condensation between transcription factor and coactivator p300 modulates transcriptional bursting kinetics”的文章。基于合成生物学、单细胞定量成像等手段,该研究的结果表明,p300可以通过其无序序列(IDR)与部分转录因子的反式激活域(TAD)相互作用,形成动态的聚集体来协调上述两种功能。TF/p300的共凝聚使p300在细胞内局部聚集,促进其反式激活反应,实现对p300催化活性的空间特异的激活,进而协助包括Brd4在内的下游共激活因子的招募。在目标基因调控层面,TF/p300的共凝聚可以影响目标基因转录的起始速度、转录爆发的持续时间等定量参数,实现非线性的激活响应。据此,该文提出了一种基于TF/p300共凝聚的基因调控模式,为理解细胞如何实现时空特异的基因激活提供了新见解。
研究人员首先在mESC、U2OS和SK-N-AS等细胞系中利用活细胞成像或者免疫荧光成像等手段观察到了p300聚集体的存在,并且发现聚集体的数量受到细胞周期及细胞大小影响,并与特定转录因子存在刺激依赖的共定位现象。基于“optoDroplet”实验的思路【6】,研究人员发现蓝光诱导转录因子TAD自聚集可以招募p300并形成共凝聚物。通过进一步定量分析,研究人员发现不同的TAD与p300形成共凝聚物的能力差异较大,例如p65TAD的能力大于p53TAD。过表达p300可以促进光诱导凝聚物的形成,并提高凝聚物的稳定性。此外,天然二聚化的转录因子rTetR或者转录因子的多聚化结构域(如p53的四聚化结构域,TD)均可促使TAD与p300形成共凝聚物。p300有约60%的无序序列,通过对p300的不同片段进行分析,研究人员发现其NTR1(氨基酸1-566)和CTR(氨基酸1856-2414)在p300形成凝聚物以及与TAD形成共凝聚物的过程中发挥主要作用。CTR富含谷氨酰胺(~20%),将其突变成丙氨酸后可以削弱其形成凝聚物的能力。
进一步的数据显示,TF/p300的共凝聚促进了p300的自激活(p300 K1499ac),且由于p300含有Bromo结构域(可以识别乙酰化的赖氨酸),因此猜测p300自激活可能提供了基于乙酰化赖氨酸的招募p300的能力,形成潜在的正反馈机制来促进聚集体的生长。为了验证此假说,研究人员利用p300酶活性抑制剂A-485处理细胞,发现较大的TF/p300聚集体很快被解聚成小的聚集体。虽然该现象符合上述假说,调控该聚集体的生长调控机制仍需要进一步探讨。更多的活细胞成像数据暗示,TF/p300的共凝聚让p300以类似“all-or-none”的方式在空间位置上被激活,进而催化乙酰化修饰、招募Brd4,该招募强度与TF/p300形成共凝聚物的能力正相关。
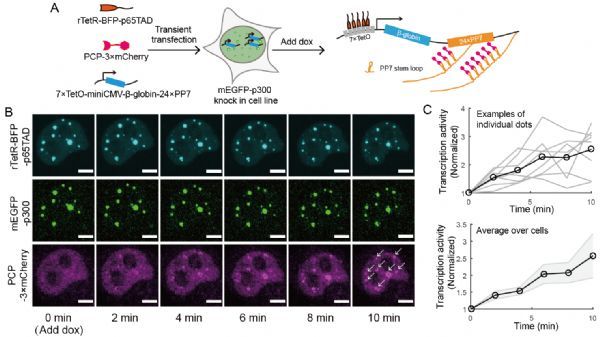
为了探究共凝聚现象的基因调控功能,研究人员首先在瞬转体系中利用实时转录报告系统展示TF/p300共凝聚物能以时空特异性的方式激活基因转录(图1),然后构建了稳定整合有十余个能同时报告转录和蛋白表达的基因位点的细胞株,并在该细胞株中转入多种TF用于分析。通过比较rTetR-p65TAD和rTetR-p53TAD调控的下游基因表达的差异,研究人员发现TF与p300形成共凝聚的能力可能与下游基因激活的强度以及与响应曲线的非线性相关。为了验证这一假说,研究人员尝试去调控p53TAD与p300形成共凝聚物的能力,构建了rTetR-p53TAD-p300CTR,rTetR-p53TAD-p300CTR(Q2A),rTetR-TD-p53TAD等合成转录因子。对这些TF介导的目标基因激活进行定量分析的结果支持上述假说,但比较有趣的是,四聚化结构域虽能提高目标蛋白表达水平,对响应曲线的非线性却没有增强。通过定量活细胞实时转录成像,研究人员发现TF/p300共凝聚调控了转录爆发的起始速度,持续时间和激活的基因个数等参数,一定程度上解释了在目标蛋白层面上所观察到的现象。基于前人高通量数据的分析结果进一步支持了上述成像数据所观察到的现象。
综上,该研究提出了一种基于TF/p300共凝聚的基因调控模式(图2),为理解转录凝聚体如何参与基因调控【7-10】提供了新的数据,但尚未对共凝聚体形成的物理化学机制进行深入细致的阐述。需要指出的是,当前领域内关于转录凝聚体是否、以及如何参与基因调控存在数种见解,虽然本研究中作者尝试了不同手段去验证TF/p300共凝聚与转录调控的潜在因果关系,但仍期待更多的数据来测试其它可能的假说。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。