胆汁淤积症突破性药物!强效回肠胆汁酸转运体抑制剂odevixibat获美国FDA优先审查!
来源:本站原创 2021-01-28 15:56
odevixibat将成为第一个治疗进行性家族性肝内胆汁淤积症(PFIC)的药物。

2021年01月28日/生物谷BIOON/--Albireo Pharma是一家开发新型胆汁酸调节剂的临床阶段罕见肝病公司。近日,该公司宣布,美国食品和药物管理局(FDA)已受理了odevixibat的新药申请(NDA),该药是一种每日一次的口服药物,用于治疗进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒。PFIC是一种罕见的、毁灭性的疾病,许多患者的唯一选择是肝移植或其他侵入性手术。
FDA已授予odevixibat NDA优先审查,并已指定《处方药用户收费法》(PDUFA)目标日期为2021年7月20日。去年12月,Albireo同时向美国FDA和欧盟EMA提交了odevixibat的上市申请文件。欧盟方面,EMA将通过加速审批程序对odevixibat进行审查。此前,EMA已授予odevixibat治疗PFIC的孤儿药资格、优先药物资格(PRIME),FDA已授予odevixibat治疗PFIC的快速通道资格(FTC)、罕见儿科疾病资格(RPDD)和孤儿药资格(ODD)。
如果获得批准,odevixibat将成为美国和欧洲第一个被批准用于PFIC的治疗药物。在获得FDA批准后,Albireo将有资格获得一张罕见儿科疾病优先审查凭证(PRV)。
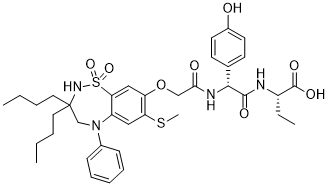
odevixibat化学结构式(图片来源:medkoo.com)
odevixibat是一种首创、强效选择性、非系统性、回肠胆汁酸转运体(IBAT)抑制剂,具有最小的全身暴露并在肠道内局部发挥作用。目前,该药正被开发用于罕见儿童胆汁淤积性肝病的治疗,包括PFIC、胆道闭锁、Alagille综合征;其中,PFIC是首个目标适应症。
Albireo总裁兼首席执行官Ron Cooper表示:“随着监管申请文件提交在创纪录的时间内完成,并已被FDA和EMA接受审查,odevixibat有潜力成为首个获准用于治疗PFIC的药物。此外,由于没有批准的治疗方法,PFIC提供了一个令人兴奋的商业机会,并将为Alagille综合征和胆道闭锁的其他适应症铺平道路。”
PFIC是一种罕见的破坏性疾病,可导致进行性的危及生命的肝病。在许多情况下,PFIC在生命的前10年会导致肝硬化和肝功能衰竭。目前,还没有药物治疗PFIC,只有手术选择。如果获得批准,odevixibat将为患有PFIC的儿童提供每日一次的口服药物选择。
PFIC(图片来源:bing.com)
2020年11月在AASLD会议上公布的数据,证实odevixibat治疗可为PFIC患者提供持久缓解。全球3期PEDFIC-1临床研究是在PFIC中开展的有史以来最大规模的研究。结果显示,研究达到了美国和欧盟监管要求的主要终点:与安慰剂相比,odevixibat显著降低了胆汁酸反应(SBA,p=0.003)、显著改善了皮肤瘙痒(p=0.004),腹泻率仅为个位数。此外,来自PEDFIC-2(开放标签3期扩展研究)的长期数据显示,在治疗长达48周的患者中,SBA持续和持久地减少、瘙痒评估得到改善、肝脏和生长功能指标令人鼓舞。在这2项研究中,odevixibat的耐受性良好,治疗引起的不良事件(TEAE)大多为轻度或中度。
总的来说,这些研究再次证实了odevixibat有潜力成为第一个被批准用于治疗PFIC的药物。PFIC是一种毁灭性的疾病,目前采用包括肝移植在内的手术治疗。odevixibat是一种安全有效的治疗药物,有潜力为PFIC患者及其家属带来真正意义上的改变。在获得监管批准后,Albireo公司计划在2021年下半年将odevixibat推向市场。
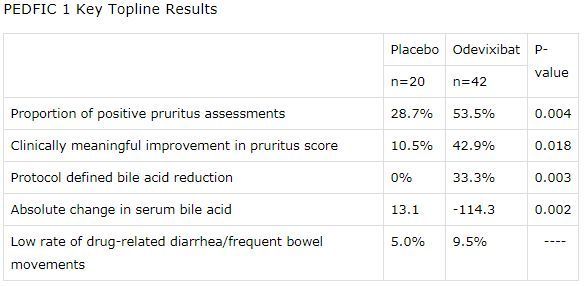
PEDFIC-1是一项随机、双盲、安慰剂对照、全球多中心3期研究,在62例年龄6个月至15.9岁的PFIC1或PFIC2患者中开展。研究中,患者随机分配,接受2种口服剂量odevixibat的商业化制剂(40μg/kg/天,120μg/kg/天)或安慰剂,每日一次治疗24周。odevixibat治疗组患者接受每日一次口服胶囊或喷剂,这2类制剂不需要冷藏。
数据显示,在主要分析中,研究达到了符合美国监管的主要终点:odevixibat治疗组瘙痒评估阳性率为53.5%、安慰剂组为28.7%(p=0.004)。次要终点方面,odevixibat治疗组有42.9%的患者瘙痒评分有临床意义改善(定义为:在0-4分量表上,第24周瘙痒评分从基线水平下降≥1.0分)、安慰剂组为10.5%(p=0.018)。
此外,该研究也达到了符合欧盟监管的主要终点:odevixibat治疗组有33.3%的患者血清胆汁酸(sBA)降低70%或达到70μmol/L水平,安慰剂组没有患者达到这一目标(p=0.003)。次要终点方面,odevixibat治疗组胆汁酸平均降低114.3μmol/L、安慰剂组增加13.1μmol/L(p=0.002)。
2种剂量odevixibat在每个终点方面均有统计学意义。研究中,odevixibat的耐受性良好。不良事件发生率与安慰剂相似。研究过程中,没有发与药物相关的严重不良事件(SAE)。腹泻/频繁排便是最常见的与治疗相关的胃肠道不良事件,在odevixibat治疗的患者中发生率为9.5%,安慰剂组为5.0%。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


