Cancer Sci:科学家有望开发出治疗多种类型癌症的靶向性疗法—“α射线导弹疗法”!
来源:本站原创 2021-01-09 15:34
2021年1月9日 讯 /生物谷BIOON/ --一种癌症特异性的L型氨基酸转运蛋白(LAT1)在癌症组织中往往会高度表达,抑制LAT1的功能或会产生抗肿瘤的效应,但目前研究人员在开发靶向作用LAT1的放射性核素疗法(radionuclide therapy)上进展非常有限。近日,一项刊登在国际杂志Cancer Science上的研究报告中,来自日本大阪大学
2021年1月9日 讯 /生物谷BIOON/ --一种癌症特异性的L型氨基酸转运蛋白(LAT1)在癌症组织中往往会高度表达,抑制LAT1的功能或会产生抗肿瘤的效应,但目前研究人员在开发靶向作用LAT1的放射性核素疗法(radionuclide therapy)上进展非常有限。近日,一项刊登在国际杂志Cancer Science上的研究报告中,来自日本大阪大学等机构的科学家们通过研究利用一种新型药物开发了一种靶向性的α疗法来靶向作用LAT1。
文章中,研究人员首次开发了α射线发射器211砹(At,Astatine),考虑到At是地球上最为稀有的自然存在元素,这对于科学家们而言或许并非一件容易的事情。靶向性的α疗法能够选择性地运输α射线发射器至肿瘤组织;与传统的β疗法相比,其优势在于α射线的衰减具有高度的靶向性,而且高线性能量的转移会导致DNA双链发生断裂,从而就会有效诱发细胞死亡。α辐射的半衰期较短,且组织穿透有限,所以就确保了其较高的治疗效果,而且对周围正常细胞的副作用较少。
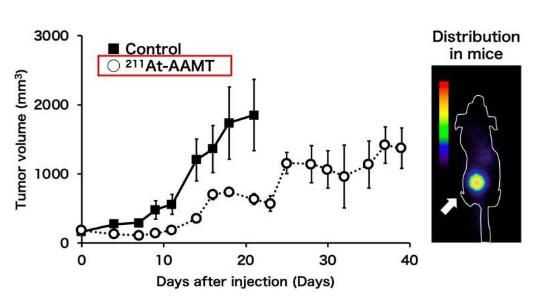
图片来源:Osaka University
接下来,为了将放射性同位素携带到癌细胞中,研究人员将其附着在α-甲基-L酪氨酸上,而α-甲基-L酪氨酸对于LAT1具有很高的亲和力,这一设计就利用了快速增值的癌细胞对营养需求增加的特点。研究者Kazuko Kaneda-Nakashima教授说道,我们发现,211At标记的α-甲基-L酪氨酸(211At-AAMT)对LAT1具有较高的亲和力,其能有效抑制肿瘤细胞,并在体外促进DNA双链破碎。随后研究人员进一步扩展了研究,他们评估了211At-AAMT的积累和LAT1在实验小鼠模型中扮演的角色;通过对人类胰腺癌细胞系进一步的研究后,研究者发现,211At-AAMT能选择性的在肿瘤中积累并抑制其生长,在较高的剂量下,其甚至还能抑制转移性黑色素瘤小鼠模型中癌症在肺部中的转移能力。
研究者Atsushi Shinohara说道,如今我们可以确定211At在治疗包括晚期和转移性癌症等癌症中的治疗效果,同时还能利用氨基酸转运蛋白LAT1来作为放射性核素疗法的转运载体;当药物被运输到癌症患处时,其就能够被癌细胞以营养物质的方式吸收从而在细胞内部对癌症进行攻击。这种新型疗法既增加了疗效,而且给药方便,作为一种可注射的短程放射性药物,211At还可以在门诊中使用,这要比传统的放射治疗存在更大优势,甚至还可以作为特定癌症外科手术的替代治疗方案。这种新方法拥有巨大的潜力,其能给放射性核素疗法带来革命性的变化,不仅有望有效治疗胰腺癌,还能帮助治疗一些缺乏有效疗法的恶性肿瘤,包括晚期或转移性癌症等。(生物谷Bioon.com)
原始出处:
Kazuko Kaneda‐Nakashima et al. α‐Emitting cancer therapy using 211 At‐AAMT targeting LAT1, Cancer Science (2020). DOI:10.1111/cas.14761
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


