2020年11月Science期刊不得不看的亮点研究
来源:本站原创 2020-11-30 23:44
2020年11月30日讯/生物谷BIOON/---2020年11月份即将结束了,11月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:揭示蛋白NRLP1特异性识别双链RNA来检测病毒感染机制doi:10.1126/science.abd0811在一项新的研究中,德国慕尼黑大学的Veit Hornung及其团
2020年11月30日讯/生物谷BIOON/---2020年11月份即将结束了,11月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:揭示蛋白NRLP1特异性识别双链RNA来检测病毒感染机制
doi:10.1126/science.abd0811
在一项新的研究中,德国慕尼黑大学的Veit Hornung及其团队证实在皮肤细胞中发现的一种称为NRLP1的蛋白能够识别病毒复制过程中形成的特定核酸中间物。这种识别过程随后会诱发一种强有力的炎症反应。相关研究结果于2020年11月26日在线发表在Science期刊上,论文标题为“Human NLRP1 is a sensor for double-stranded RNA”。
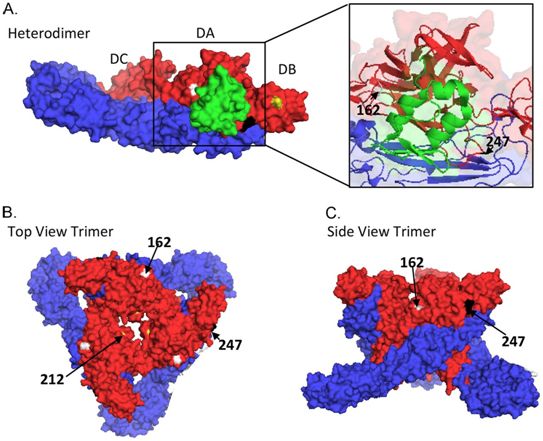
区分自我和潜在有害的非自我的能力对有机体维持完整性和存活下来至关重要。在大多数有机体中,所谓的先天免疫系统负责识别这样的入侵者(非自我)。在执行这一任务的蛋白中,有一类称为炎性体传感蛋白(inflammasome sensor)的蛋白。一旦被激活,这些传感蛋白就会形成炎性体复合物,然后引发一系列炎症反应,在某些情况下会导致感染细胞的死亡。
在这项新的研究中,Hornung团队与慕尼黑工业大学和马克斯-普朗克生物化学研究所的同事们合作,如今证实在皮肤细胞中发现的一种这样的传感蛋白直接与某些RNA病毒复制过程中产生的特定分子结构结合。这些新发现强调了上皮细胞作为抵御入侵病原体屏障的重要性。
2.Science:改写教科书!揭示Rho让RNA聚合酶失活终止转录新机制
doi:10.1126/science.abd1673
在转录过程中,一种称为RNA聚合酶的酶将自身包裹在DNA的双螺旋周围,使用一条DNA链与核苷酸匹配以形成遗传物质的副本---一条新合成的RNA链,该RNA链的合成在转录完成后会释放出来。所产生的RNA可以产生蛋白,而蛋白对于所有生命都是必不可少的,并可以在细胞内完成大部分工作。
就像任何连贯的信息一样,RNA转录需要在正确的位置启动和停止才有意义。50年前发现了一种叫做Rho的细菌蛋白,它具有停止或终止转录的能力。在每本教科书中,Rho都用作模型终止子,利用它的强大动力,与RNA结合并将它从RNA聚合酶中拉出。但是,在一项新的研究中,来自德国柏林自由大学、亥姆霍兹柏林材料与能源中心和美国俄亥俄州立大学等研究机构的研究人员仔细观察后发现,Rho无法使用教科书中描述的机制找到需要释放的RNA。相关研究结果于2020年11月26日在线发表在Science期刊上,论文标题为“Steps toward translocation-independent RNA polymerase inactivation by terminator ATPase ρ”。
这项研究确定Rho不是在转录即将结束时附着在特定的RNA片段上并帮助它从DNA上解脱出来,而是在转录持续期间在RNA聚合酶上“搭便车”。Rho与其他蛋白协同作用,诱导RNA聚合酶发生一系列结构改变而最终进入无活性状态,从而让RNA得以释放。
3. Science:借助大数据开发出治疗癌症的“智能”细胞疗法
doi:10.1126/science.abc6270
寻找既能杀死癌细胞又能让正常组织不受伤害的药物是肿瘤学研究的最高目标。在两篇新的论文中,来自美国加州大学旧金山分校和普林斯顿大学的研究人员提出用“智能(smart)”细胞疗法破解这一难题的互补策略:除非被仅在癌细胞中同时出现的一组蛋白所激活,否则这些活的细胞药物会保持惰性。
这种通用方法的生物学方面已经在Wendell Lim博士及其同事们在加州大学旧金山分校细胞设计计划和美国国家癌症研究所赞助的合成免疫学中心的实验室中探索了好几年。但是,他们的新研究通过将前沿的治疗细胞工程与先进的计算方法相结合,为这方面增加了一个强大的新维度。
在第一篇发表在2020年9月23日的Cell Systems期刊上的标题为“Discriminatory Power of Combinatorial Antigen Recognition in Cancer T Cell Therapies”的论文中,Lim实验室的成员与普林斯顿大学路易斯-西格勒综合基因组学研究所计算机科学家Olga G. Troyanskaya博士的研究小组联手。通过使用机器学习方法,他们分析了在癌症和正常细胞中发现的数千种蛋白的海量数据库。随后,他们筛选了数百万种可能的蛋白组合,以构建出一个蛋白组合目录,可用于精确地只靶向癌细胞,而不靶向正常细胞。
在第二篇发表在2020年11月27日的Science期刊上的标题为“Precise T cell recognition programs designed by transcriptionally linking multiple receptors”的论文中,Lim及其同事们随后展示了如何将这些通过计算得出的蛋白数据用于推动设计有效和高度选择性的癌症细胞疗法。
4.Science论文解读!湖南省年初的新冠病毒传播存在大量的异质性,隔离措施成功阻断该地区的病毒传播
doi:10.1126/science.abe2424
在一项新的研究中,来自中国复旦大学、湖南省疾病预防控制中心、美国国家卫生研究院和印第安纳大学公共卫生学院等研究机构的研究人员基于通过广泛的监测和接触者追踪工作收集的细化流行病学信息,重建了截至2020年4月3日湖南省所有已确认的SARS-CoV-2感染者之间的传播链。相关研究结果于2020年11月24日在线发表在Science期刊上,论文标题为“Transmission heterogeneities, kinetics, and controllability of SARS-CoV-2”。论文通讯作者为复旦大学公共卫生学院的余宏杰(Hongjie Yu)教授和美国国家卫生研究院的Kaiyuan Sun博士。
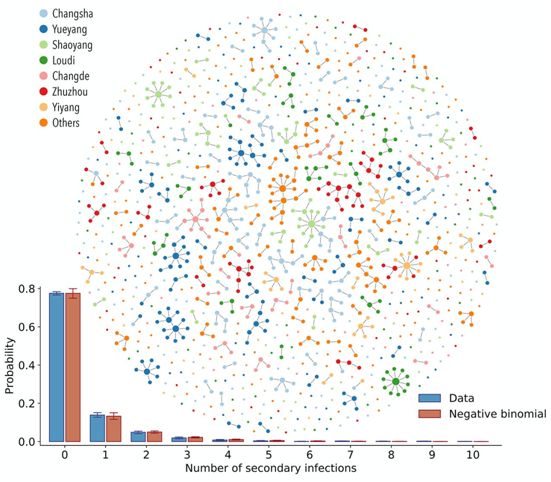
这些作者确定了驱动传播异质性的人口、临床和行为因素,并评估了干预措施如何调节传播网络的拓扑结构。此外,他们重建了SARS-CoV-2在典型感染过程中的感染谱(infectiousness profile),并估计了通过基于个体和人群的干预措施控制疫情的可行性。
根据中国湖南患者和接触者的详细追踪数据,这些作者发现80%的继发感染可追溯到15%的SARS-CoV-2原发感染,这表明存在大量的传播异质性。传播风险与接触时间和社会互动的密切程度呈正相关,并受到人口统计学和临床因素的调节。封锁增加了家庭和家庭中的传播风险,而隔离减少了所有类型接触者的风险。针对典型SARS-CoV-2患者重建的感染谱在症状出现前达到峰值。建模结果表明,由于这种病毒的特定传播动力学,控制SARS-CoV-2疫情需要病例隔离、接触者隔离和人群水平干预措施的协同作用。
总的来说,这些作者发现病例隔离成功地阻断了湖南地区密切接触者的传播,估计有4.3%的传播发生在SARS-CoV-2患者被隔离后。在这种情况下,所有SARS-CoV-2感染者无论临床严重程度如何都在专门的医院进行医学隔离管理,而接触者则在指定的医学观察中心进行隔离。然而,在家中进行自我隔离可能并不那么有效,预计继续传播的比例应该更高。
5.Science:重磅!揭示ZSWIM8泛素连接酶介导靶标指导的microRNA降解机制
doi:10.1126/science.abc9359
微小核糖核酸(microRNA, miRNA)是一段短的RNA序列,它能严格控制哪些基因表达和基因表达的时间。它们通过调节哪些信使RNA(mRNA)转录本---编码蛋白的单链模板---被细胞实际读取来做到这一点。但是,是什么控制着这些细胞调节因子呢?在一项新的研究中,来自美国怀特黑德生物医学研究所、麻省理工学院、威尔康奈尔医学院和霍华德-休斯医学研究所的研究人员发现mRNA和其他RNA经常逆向作用于它们的miRNA调控因子,并证实miRNA降解路径并不是科学家们所期望的那样。相关研究结果于2020年11月12日在线发表在Science期刊上,论文标题为“The ZSWIM8 ubiquitin ligase mediates target-directed microRNA degradation”。论文通讯作者为怀特黑德生物医学研究所的David Bartel博士。
miRNA通常通过与mRNA转录本结合来控制基因的表达,然后与一种叫做Argonaute的蛋白一起发挥作用,从而沉默这些转录本以便它们更快地被降解。鉴于miRNA被安稳地固定在Argonaute蛋白的内部,它们被屏蔽在细胞中的破坏性酶之外,因此以细胞标准来看,它们的寿命相当长。它们可以持续存在长达一周的时间,在这段时间内造成许多mRNA分子受到破坏。然而,有时,miRNA与mRNA转录本上的一个特殊靶位点结合,导致miRNA过早地被破坏。这种现象称为靶标引导的miRNA降解(target-directed microRNA degradation, TDMD),在细胞中自然发生,是一种控制在任何给定时间内允许多少某些miRNA持续存在的方法。
在Bartel实验室发现一种称为CYRANO的RNA不编码任何蛋白,可导致一种称为miR-7的特定miRNA的降解。此后,这些研究人员便开始研究这种形式的降解。这种相互作用对他们来说很有趣,这是因为这种机制似乎与目前关于TDMD的理论不一致。为了进一步探究TDMD的机制,这些研究人员重点研究了CYRANO非编码RNA和miR-7之间的这种相互作用。Shi设计了CRISPR筛选,以确定当这个miRNA遇到CYRANO转录本时对它的降解至关重要的基因。这种CRISPR筛选确定了一个对这个miRNA的降解至关重要的基因,即ZSWIM8。当他们研究该基因的功能时,他们发现它编码的是泛素连接酶(ubiquitin ligase)的一个组分。泛素之所以如此命名,是因为它几乎在所有类型的细胞中都能找到。泛素对蛋白进行标记,以便后者在一种称为蛋白酶体(proteasome)的细胞垃圾处理系统中遭受降解。
ZSWIM8泛素连接酶的发现意味着CYRANO介导的miRNA降解涉及Argonaute蛋白受到破坏。在这种新的TDMD分子模型中,作为一种调节性RNA,CYRANO结合到封装在保护性的Argonaute蛋白中的mir-7,然后招募ZSWIM8泛素连接酶。随后,这种连接酶将一些泛素分子添加到这个miRNA的Argonaute上,导致Argonaute受到降解,从而使得它携带的miRNA货物暴露出来,以便细胞中的酶破坏这种miRNA货物。重要的是,这个过程不需要对miRNA进行任何修剪和加尾处理。
6.Science:重磅!揭示介导microRNA降解的新机制,有望开发出治疗各种疾病的新疗法
doi:10.1126/science.abc9546
在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现一种细胞用来降解微小核糖核酸(microRNA, miRNA)的机制,其中miRNA是调节细胞中蛋白数量的遗传分子。这一发现不仅阐明了细胞的内部运作情况,而且最终可能让人们开发出对抗传染病、癌症和其他一系列健康问题的新方法。相关研究结果于2020年11月12日在线发表在Science期刊上,论文标题为“A ubiquitin ligase mediates target-directed microRNA decay independently of tailing and trimming”。
只要miRNA分子在细胞中停留,它们就会减少靶mRNA编码的蛋白产生。因此,了解细胞如何在不再需要miRNA时除去它们是充分理解它们如何以及何时发挥它们的作用的关键。为了回答这个问题,Mendell、Han和他们的同事利用CRISPR-Cas9,这是一种基因编辑工具,最近开发它的两位科学家获得了2020年诺贝尔化学奖。Mendell说,通过充当“分子剪刀”,这个基因编辑系统可以移除单个基因,让人们探索该基因的功能。
在一种称为K562的人类癌症细胞系中,这些研究人员利用CRISPR-Cas9靶向人类基因组中2万个蛋白编码基因中的大部分,旨在寻找任何导致一种通常寿命较短的称为miR-7的miRNA在细胞中停留的基因。他们的搜索最终发现,至少有10个基因是降解这种miRNA所需要的。他们了解到,这些基因编码的蛋白在细胞中聚集在一起,形成一个更大的称为cullin-RING泛素连接酶(cullin-RING ubiquitin ligase, CRL)的复合物,这个复合物的功能是标记其他蛋白以便后者随后遭受破坏。Mendell说,这种特殊的泛素连接酶以前从未被描述过,但是像其他泛素连接酶复合物一样,它似乎是为了标记注定要遭受降解的蛋白。然而,进一步的研究表明,CRL不是标记miR-7本身,而是标记一种名为Argonaute的蛋白,该蛋白可以在细胞中运输miRNA。一旦附着在miR-7上的Argonaute蛋白遭受靶向降解,这个miRNA就会裸露在细胞中---这种状态会触发细胞使用RNA降解酶来破坏这个miRNA。
7.两篇Science论文构建出胎儿基因表达和染色质可及性的人类细胞图谱,有助揭示人细胞生长和发育机制
doi:10.1126/science.aba7721; doi:10.1126/science.aba7612
在两项新的研究中,来自美国华盛顿大学医学院和布罗特曼-巴蒂精准医学研究所等研究机构的研究人员构建出两个细胞图谱,用于追踪人类细胞类型和组织发育过程中的基因表达和和染色质可及性(chromatin accessibility,也译为染色质可访问性)。其中的一个细胞图谱绘制了15种胎儿组织中单个细胞内的基因表达,另一个细胞图谱绘制了这些细胞内单个细胞的染色质可及性。相关研究结果发表在2020年11月13日的两篇Science论文中,论文标题分别为“A human cell atlas of fetal gene expression”和“A human cell atlas of fetal chromatin accessibility”。
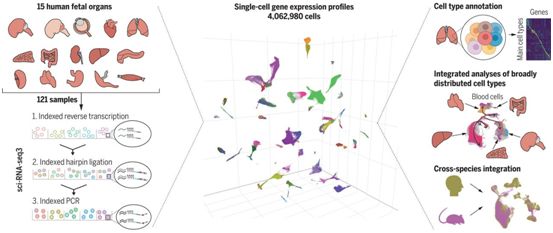
这些图谱共同为了解人类发育过程中的基因表达和染色质可及性提供了规模空前的基础资源。此外,这两篇论文中描述的技术使得生成数百万个细胞的基因表达和染色质可及性数据成为可能。
在第一项研究中,为了创建基因表达图谱,这些研究人员通过使用一种名为 sci-RNA-seq3 的技术,对 15 种胎儿组织的基因表达进行了剖析。这种技术为每个细胞贴上了三个DNA条形码的独特组合标签,从而使得他们能够在不进行物理分离的情况下跟踪这些细胞。
在这些获得DNA条形码序列后,他们使用计算机算法获得单细胞信息,按细胞类型和亚型对细胞进行聚类,并确定它们的发育轨迹。他们对400多万个单细胞进行了剖析,确定了77种主要的细胞类型和大约650种细胞亚型。
在第二项研究中,为了剖析单个细胞中的DNA可及性,这些研究人员开发了一种新的方法,称为 sci-ATAC-seq3。与 sci-RNA-seq3 一样,这种技术也是在每个细胞中使用三个不同的 DNA “条形码”来标记和追踪单个细胞。然而,sci-ATAC-seq3并不识别所有当前表达的序列,而是捕捉开放的染色质位点并进行测序。
在这项新的研究中,这些研究人员在15种胎儿组织的大约100万个位点上生成了近80万个单细胞染色质可及性数据。他们研究了哪些蛋白可能与每个细胞中的可访问DNA位点相互作用,以及这些相互作用如何解释细胞类型。这一分析确定了基因组内的发育控制开关。他们还确定了可能与疾病相关的染色质可访问性位点。
8.Science论文深度解读!新研究揭示增强子在动物体内是非常保守的
doi:10.1126/science.aax8137; doi:10.1126/science.abe9317
在一项新的研究中,来自澳大利亚昆士兰大学、新南威尔士大学、莫纳什大学、墨尔本大学、悉尼大学和张任谦心脏研究所的研究人员发现称为增强子的基因调控元件的功能在进化树上分布的动物物种中广泛保守。当他们将来自海绵动物的增强子序列插入斑马鱼和小鼠体内时,这两种脊椎动物都能够解释遗传信息,并驱动发育基因的细胞特异性表达,甚至在海绵动物没有的细胞类型中也是如此。这些研究结果表明至少在某些情况下,增强子的功能在远在7亿年前最后一个共同祖先的物种中持续存在。相关研究结果发表在2020年11月6日的Science期刊上,论文标题为“Deep conservation of the enhancer regulatory code in animals”。
一旦被蛋白结合,增强子就会控制基因在哪里、何时以及如何受到调控,并在很大程度上负责发育过程中的细胞分化。论文共同通讯作者、张任谦心脏研究所计算基因组学研究员Emily Wong告诉《科学家》杂志,“肌肉细胞之所以与皮肤细胞不同,都是因为基因受到调控的方式不同。这就是为何了解这些区域真地很重要。我们的发现是令人兴奋的,这是因为我们知道这些区域的进化非常迅速,从而使得它们很难找到。”
9.Science:重大进展!利用新开发的CRISPR-LICHT技术筛选出决定人类大脑大小的基因
doi:10.1126/science.abb5390
在果蝇和线虫身上可以常规地进行遗传筛选。在人类中,存在着丰富的关于遗传病和疾病相关突变后果的知识,但对人类进行系统性分析是不可能的。如今,在一项新的研究中,来自奥地利维也纳生物中心(Vienna BioCenter)、维也纳大学和维也纳医科大学的研究人 员开发出一种突破性的技术,这种技术允许在人类组织中并行分析数百个基因。他们将这种新技术命名为CRISPR-LICHT。相关研究结果近期发表在Science期刊上,论文标题为“A human tissue screen identifies a regulator of ER secretion as a brain size determinant”。
论文共同第一作者、IMBA博士生Dominik Lindenhofer解释说,“这种技术是基于众所周知的在2020年10月获得诺贝尔奖的CRISPR-Cas9技术和双条码方法的结合。关键的技巧是使用向导RNA(gRNA),同时也使用一种基因条形码,即我们添加到用来培养类器官的细胞基因 组中的DNA片段。这让我们可以看到每个类器官的完整细胞谱系,而第二种条形码让我们可以计算每个起始细胞产生的细胞数量。这降低了噪音,因此我们可以确定每种gRNA对类器官生长过程中产生的细胞数量的影响。为了描述我们的方法,我们将之称为CRISPR-LICHT( CRIPSR-Lineage Tracing at Cellular resolution in Heterogenous Tissue,利用CRipsR在异质组织中进行细胞分辨率下的谱系追踪)。”
这些研究人员将CRISPR-LICHT应用于小头畸形(microcephaly),即一种以患者大脑尺寸缩小和严重智力障碍为典型特征的遗传性疾病。通过这种革命性的新技术,他们筛选出了所有疑似在这种疾病中发挥作用的基因。
10.Science:临床前研究显示母体可将过敏传递给后代
doi:10.1126/science.aba0864; doi:10.1126/science.abe8283
在一项新的研究中,来自新加坡科技研究局(A*STAR)、新加坡竹脚妇幼医院、杜克-新加坡国立大学医学院、新加坡国立大学、中国上海交通大学和美国杜克大学等研究机构的研究人员报告,母体可以在它们的后代在子宫内发育时将过敏传给后者。相关研究结果近期发 表在Science期刊上,论文标题为“Fetal mast cells mediate postnatal allergic responses dependent on maternal IgE”。
这项研究采用了符合新加坡国家实验动物研究咨询委员会(NACLAR)指南的动物模型,发现负责引发过敏反应的关键抗体--免疫球蛋白E(IgE)---可以穿过胎盘进入胎儿体内。当进入胎儿体内时,这种抗体会与胎儿肥大细胞结合,其中肥大细胞是一种免疫细胞,会释放 引发从流鼻涕到哮喘等过敏反应的化学物。出生后,新生小鼠在第一次接触过敏原时,会与它们的母体那样对相同类型的过敏原产生过敏反应,不同的是,成年小鼠需要两次接触过敏原才能产生过敏反应。实验室的研究还表明,母体IgE可以与人类胎儿肥大细胞结合,表 明它们可能以类似的方式穿过人类的胎盘。(生物谷 Bioon.com)
1.Science:揭示蛋白NRLP1特异性识别双链RNA来检测病毒感染机制
doi:10.1126/science.abd0811
在一项新的研究中,德国慕尼黑大学的Veit Hornung及其团队证实在皮肤细胞中发现的一种称为NRLP1的蛋白能够识别病毒复制过程中形成的特定核酸中间物。这种识别过程随后会诱发一种强有力的炎症反应。相关研究结果于2020年11月26日在线发表在Science期刊上,论文标题为“Human NLRP1 is a sensor for double-stranded RNA”。

图片来自Journal of Virology, 2015, doi:10.1128/JVI.03645-14。
区分自我和潜在有害的非自我的能力对有机体维持完整性和存活下来至关重要。在大多数有机体中,所谓的先天免疫系统负责识别这样的入侵者(非自我)。在执行这一任务的蛋白中,有一类称为炎性体传感蛋白(inflammasome sensor)的蛋白。一旦被激活,这些传感蛋白就会形成炎性体复合物,然后引发一系列炎症反应,在某些情况下会导致感染细胞的死亡。
在这项新的研究中,Hornung团队与慕尼黑工业大学和马克斯-普朗克生物化学研究所的同事们合作,如今证实在皮肤细胞中发现的一种这样的传感蛋白直接与某些RNA病毒复制过程中产生的特定分子结构结合。这些新发现强调了上皮细胞作为抵御入侵病原体屏障的重要性。
2.Science:改写教科书!揭示Rho让RNA聚合酶失活终止转录新机制
doi:10.1126/science.abd1673
在转录过程中,一种称为RNA聚合酶的酶将自身包裹在DNA的双螺旋周围,使用一条DNA链与核苷酸匹配以形成遗传物质的副本---一条新合成的RNA链,该RNA链的合成在转录完成后会释放出来。所产生的RNA可以产生蛋白,而蛋白对于所有生命都是必不可少的,并可以在细胞内完成大部分工作。
就像任何连贯的信息一样,RNA转录需要在正确的位置启动和停止才有意义。50年前发现了一种叫做Rho的细菌蛋白,它具有停止或终止转录的能力。在每本教科书中,Rho都用作模型终止子,利用它的强大动力,与RNA结合并将它从RNA聚合酶中拉出。但是,在一项新的研究中,来自德国柏林自由大学、亥姆霍兹柏林材料与能源中心和美国俄亥俄州立大学等研究机构的研究人员仔细观察后发现,Rho无法使用教科书中描述的机制找到需要释放的RNA。相关研究结果于2020年11月26日在线发表在Science期刊上,论文标题为“Steps toward translocation-independent RNA polymerase inactivation by terminator ATPase ρ”。
这项研究确定Rho不是在转录即将结束时附着在特定的RNA片段上并帮助它从DNA上解脱出来,而是在转录持续期间在RNA聚合酶上“搭便车”。Rho与其他蛋白协同作用,诱导RNA聚合酶发生一系列结构改变而最终进入无活性状态,从而让RNA得以释放。
3. Science:借助大数据开发出治疗癌症的“智能”细胞疗法
doi:10.1126/science.abc6270
寻找既能杀死癌细胞又能让正常组织不受伤害的药物是肿瘤学研究的最高目标。在两篇新的论文中,来自美国加州大学旧金山分校和普林斯顿大学的研究人员提出用“智能(smart)”细胞疗法破解这一难题的互补策略:除非被仅在癌细胞中同时出现的一组蛋白所激活,否则这些活的细胞药物会保持惰性。
这种通用方法的生物学方面已经在Wendell Lim博士及其同事们在加州大学旧金山分校细胞设计计划和美国国家癌症研究所赞助的合成免疫学中心的实验室中探索了好几年。但是,他们的新研究通过将前沿的治疗细胞工程与先进的计算方法相结合,为这方面增加了一个强大的新维度。
在第一篇发表在2020年9月23日的Cell Systems期刊上的标题为“Discriminatory Power of Combinatorial Antigen Recognition in Cancer T Cell Therapies”的论文中,Lim实验室的成员与普林斯顿大学路易斯-西格勒综合基因组学研究所计算机科学家Olga G. Troyanskaya博士的研究小组联手。通过使用机器学习方法,他们分析了在癌症和正常细胞中发现的数千种蛋白的海量数据库。随后,他们筛选了数百万种可能的蛋白组合,以构建出一个蛋白组合目录,可用于精确地只靶向癌细胞,而不靶向正常细胞。
在第二篇发表在2020年11月27日的Science期刊上的标题为“Precise T cell recognition programs designed by transcriptionally linking multiple receptors”的论文中,Lim及其同事们随后展示了如何将这些通过计算得出的蛋白数据用于推动设计有效和高度选择性的癌症细胞疗法。
4.Science论文解读!湖南省年初的新冠病毒传播存在大量的异质性,隔离措施成功阻断该地区的病毒传播
doi:10.1126/science.abe2424
在一项新的研究中,来自中国复旦大学、湖南省疾病预防控制中心、美国国家卫生研究院和印第安纳大学公共卫生学院等研究机构的研究人员基于通过广泛的监测和接触者追踪工作收集的细化流行病学信息,重建了截至2020年4月3日湖南省所有已确认的SARS-CoV-2感染者之间的传播链。相关研究结果于2020年11月24日在线发表在Science期刊上,论文标题为“Transmission heterogeneities, kinetics, and controllability of SARS-CoV-2”。论文通讯作者为复旦大学公共卫生学院的余宏杰(Hongjie Yu)教授和美国国家卫生研究院的Kaiyuan Sun博士。

湖南省的SARS-CoV-2传播链,图片来自Science, 2020, doi:10.1126/science.abe2424。
这些作者确定了驱动传播异质性的人口、临床和行为因素,并评估了干预措施如何调节传播网络的拓扑结构。此外,他们重建了SARS-CoV-2在典型感染过程中的感染谱(infectiousness profile),并估计了通过基于个体和人群的干预措施控制疫情的可行性。
根据中国湖南患者和接触者的详细追踪数据,这些作者发现80%的继发感染可追溯到15%的SARS-CoV-2原发感染,这表明存在大量的传播异质性。传播风险与接触时间和社会互动的密切程度呈正相关,并受到人口统计学和临床因素的调节。封锁增加了家庭和家庭中的传播风险,而隔离减少了所有类型接触者的风险。针对典型SARS-CoV-2患者重建的感染谱在症状出现前达到峰值。建模结果表明,由于这种病毒的特定传播动力学,控制SARS-CoV-2疫情需要病例隔离、接触者隔离和人群水平干预措施的协同作用。
总的来说,这些作者发现病例隔离成功地阻断了湖南地区密切接触者的传播,估计有4.3%的传播发生在SARS-CoV-2患者被隔离后。在这种情况下,所有SARS-CoV-2感染者无论临床严重程度如何都在专门的医院进行医学隔离管理,而接触者则在指定的医学观察中心进行隔离。然而,在家中进行自我隔离可能并不那么有效,预计继续传播的比例应该更高。
5.Science:重磅!揭示ZSWIM8泛素连接酶介导靶标指导的microRNA降解机制
doi:10.1126/science.abc9359
微小核糖核酸(microRNA, miRNA)是一段短的RNA序列,它能严格控制哪些基因表达和基因表达的时间。它们通过调节哪些信使RNA(mRNA)转录本---编码蛋白的单链模板---被细胞实际读取来做到这一点。但是,是什么控制着这些细胞调节因子呢?在一项新的研究中,来自美国怀特黑德生物医学研究所、麻省理工学院、威尔康奈尔医学院和霍华德-休斯医学研究所的研究人员发现mRNA和其他RNA经常逆向作用于它们的miRNA调控因子,并证实miRNA降解路径并不是科学家们所期望的那样。相关研究结果于2020年11月12日在线发表在Science期刊上,论文标题为“The ZSWIM8 ubiquitin ligase mediates target-directed microRNA degradation”。论文通讯作者为怀特黑德生物医学研究所的David Bartel博士。
miRNA通常通过与mRNA转录本结合来控制基因的表达,然后与一种叫做Argonaute的蛋白一起发挥作用,从而沉默这些转录本以便它们更快地被降解。鉴于miRNA被安稳地固定在Argonaute蛋白的内部,它们被屏蔽在细胞中的破坏性酶之外,因此以细胞标准来看,它们的寿命相当长。它们可以持续存在长达一周的时间,在这段时间内造成许多mRNA分子受到破坏。然而,有时,miRNA与mRNA转录本上的一个特殊靶位点结合,导致miRNA过早地被破坏。这种现象称为靶标引导的miRNA降解(target-directed microRNA degradation, TDMD),在细胞中自然发生,是一种控制在任何给定时间内允许多少某些miRNA持续存在的方法。
在Bartel实验室发现一种称为CYRANO的RNA不编码任何蛋白,可导致一种称为miR-7的特定miRNA的降解。此后,这些研究人员便开始研究这种形式的降解。这种相互作用对他们来说很有趣,这是因为这种机制似乎与目前关于TDMD的理论不一致。为了进一步探究TDMD的机制,这些研究人员重点研究了CYRANO非编码RNA和miR-7之间的这种相互作用。Shi设计了CRISPR筛选,以确定当这个miRNA遇到CYRANO转录本时对它的降解至关重要的基因。这种CRISPR筛选确定了一个对这个miRNA的降解至关重要的基因,即ZSWIM8。当他们研究该基因的功能时,他们发现它编码的是泛素连接酶(ubiquitin ligase)的一个组分。泛素之所以如此命名,是因为它几乎在所有类型的细胞中都能找到。泛素对蛋白进行标记,以便后者在一种称为蛋白酶体(proteasome)的细胞垃圾处理系统中遭受降解。
ZSWIM8泛素连接酶的发现意味着CYRANO介导的miRNA降解涉及Argonaute蛋白受到破坏。在这种新的TDMD分子模型中,作为一种调节性RNA,CYRANO结合到封装在保护性的Argonaute蛋白中的mir-7,然后招募ZSWIM8泛素连接酶。随后,这种连接酶将一些泛素分子添加到这个miRNA的Argonaute上,导致Argonaute受到降解,从而使得它携带的miRNA货物暴露出来,以便细胞中的酶破坏这种miRNA货物。重要的是,这个过程不需要对miRNA进行任何修剪和加尾处理。
6.Science:重磅!揭示介导microRNA降解的新机制,有望开发出治疗各种疾病的新疗法
doi:10.1126/science.abc9546
在一项新的研究中,来自美国德克萨斯大学西南医学中心的研究人员发现一种细胞用来降解微小核糖核酸(microRNA, miRNA)的机制,其中miRNA是调节细胞中蛋白数量的遗传分子。这一发现不仅阐明了细胞的内部运作情况,而且最终可能让人们开发出对抗传染病、癌症和其他一系列健康问题的新方法。相关研究结果于2020年11月12日在线发表在Science期刊上,论文标题为“A ubiquitin ligase mediates target-directed microRNA decay independently of tailing and trimming”。
只要miRNA分子在细胞中停留,它们就会减少靶mRNA编码的蛋白产生。因此,了解细胞如何在不再需要miRNA时除去它们是充分理解它们如何以及何时发挥它们的作用的关键。为了回答这个问题,Mendell、Han和他们的同事利用CRISPR-Cas9,这是一种基因编辑工具,最近开发它的两位科学家获得了2020年诺贝尔化学奖。Mendell说,通过充当“分子剪刀”,这个基因编辑系统可以移除单个基因,让人们探索该基因的功能。
在一种称为K562的人类癌症细胞系中,这些研究人员利用CRISPR-Cas9靶向人类基因组中2万个蛋白编码基因中的大部分,旨在寻找任何导致一种通常寿命较短的称为miR-7的miRNA在细胞中停留的基因。他们的搜索最终发现,至少有10个基因是降解这种miRNA所需要的。他们了解到,这些基因编码的蛋白在细胞中聚集在一起,形成一个更大的称为cullin-RING泛素连接酶(cullin-RING ubiquitin ligase, CRL)的复合物,这个复合物的功能是标记其他蛋白以便后者随后遭受破坏。Mendell说,这种特殊的泛素连接酶以前从未被描述过,但是像其他泛素连接酶复合物一样,它似乎是为了标记注定要遭受降解的蛋白。然而,进一步的研究表明,CRL不是标记miR-7本身,而是标记一种名为Argonaute的蛋白,该蛋白可以在细胞中运输miRNA。一旦附着在miR-7上的Argonaute蛋白遭受靶向降解,这个miRNA就会裸露在细胞中---这种状态会触发细胞使用RNA降解酶来破坏这个miRNA。
7.两篇Science论文构建出胎儿基因表达和染色质可及性的人类细胞图谱,有助揭示人细胞生长和发育机制
doi:10.1126/science.aba7721; doi:10.1126/science.aba7612
在两项新的研究中,来自美国华盛顿大学医学院和布罗特曼-巴蒂精准医学研究所等研究机构的研究人员构建出两个细胞图谱,用于追踪人类细胞类型和组织发育过程中的基因表达和和染色质可及性(chromatin accessibility,也译为染色质可访问性)。其中的一个细胞图谱绘制了15种胎儿组织中单个细胞内的基因表达,另一个细胞图谱绘制了这些细胞内单个细胞的染色质可及性。相关研究结果发表在2020年11月13日的两篇Science论文中,论文标题分别为“A human cell atlas of fetal gene expression”和“A human cell atlas of fetal chromatin accessibility”。

图片来自Science, 2020, doi:10.1126/science.aba7721。
这些图谱共同为了解人类发育过程中的基因表达和染色质可及性提供了规模空前的基础资源。此外,这两篇论文中描述的技术使得生成数百万个细胞的基因表达和染色质可及性数据成为可能。
在第一项研究中,为了创建基因表达图谱,这些研究人员通过使用一种名为 sci-RNA-seq3 的技术,对 15 种胎儿组织的基因表达进行了剖析。这种技术为每个细胞贴上了三个DNA条形码的独特组合标签,从而使得他们能够在不进行物理分离的情况下跟踪这些细胞。
在这些获得DNA条形码序列后,他们使用计算机算法获得单细胞信息,按细胞类型和亚型对细胞进行聚类,并确定它们的发育轨迹。他们对400多万个单细胞进行了剖析,确定了77种主要的细胞类型和大约650种细胞亚型。
在第二项研究中,为了剖析单个细胞中的DNA可及性,这些研究人员开发了一种新的方法,称为 sci-ATAC-seq3。与 sci-RNA-seq3 一样,这种技术也是在每个细胞中使用三个不同的 DNA “条形码”来标记和追踪单个细胞。然而,sci-ATAC-seq3并不识别所有当前表达的序列,而是捕捉开放的染色质位点并进行测序。
在这项新的研究中,这些研究人员在15种胎儿组织的大约100万个位点上生成了近80万个单细胞染色质可及性数据。他们研究了哪些蛋白可能与每个细胞中的可访问DNA位点相互作用,以及这些相互作用如何解释细胞类型。这一分析确定了基因组内的发育控制开关。他们还确定了可能与疾病相关的染色质可访问性位点。
8.Science论文深度解读!新研究揭示增强子在动物体内是非常保守的
doi:10.1126/science.aax8137; doi:10.1126/science.abe9317
在一项新的研究中,来自澳大利亚昆士兰大学、新南威尔士大学、莫纳什大学、墨尔本大学、悉尼大学和张任谦心脏研究所的研究人员发现称为增强子的基因调控元件的功能在进化树上分布的动物物种中广泛保守。当他们将来自海绵动物的增强子序列插入斑马鱼和小鼠体内时,这两种脊椎动物都能够解释遗传信息,并驱动发育基因的细胞特异性表达,甚至在海绵动物没有的细胞类型中也是如此。这些研究结果表明至少在某些情况下,增强子的功能在远在7亿年前最后一个共同祖先的物种中持续存在。相关研究结果发表在2020年11月6日的Science期刊上,论文标题为“Deep conservation of the enhancer regulatory code in animals”。
一旦被蛋白结合,增强子就会控制基因在哪里、何时以及如何受到调控,并在很大程度上负责发育过程中的细胞分化。论文共同通讯作者、张任谦心脏研究所计算基因组学研究员Emily Wong告诉《科学家》杂志,“肌肉细胞之所以与皮肤细胞不同,都是因为基因受到调控的方式不同。这就是为何了解这些区域真地很重要。我们的发现是令人兴奋的,这是因为我们知道这些区域的进化非常迅速,从而使得它们很难找到。”
9.Science:重大进展!利用新开发的CRISPR-LICHT技术筛选出决定人类大脑大小的基因
doi:10.1126/science.abb5390
在果蝇和线虫身上可以常规地进行遗传筛选。在人类中,存在着丰富的关于遗传病和疾病相关突变后果的知识,但对人类进行系统性分析是不可能的。如今,在一项新的研究中,来自奥地利维也纳生物中心(Vienna BioCenter)、维也纳大学和维也纳医科大学的研究人 员开发出一种突破性的技术,这种技术允许在人类组织中并行分析数百个基因。他们将这种新技术命名为CRISPR-LICHT。相关研究结果近期发表在Science期刊上,论文标题为“A human tissue screen identifies a regulator of ER secretion as a brain size determinant”。

图片来自Science, 2020, doi:10.1126/science.abb5390。
论文共同第一作者、IMBA博士生Dominik Lindenhofer解释说,“这种技术是基于众所周知的在2020年10月获得诺贝尔奖的CRISPR-Cas9技术和双条码方法的结合。关键的技巧是使用向导RNA(gRNA),同时也使用一种基因条形码,即我们添加到用来培养类器官的细胞基因 组中的DNA片段。这让我们可以看到每个类器官的完整细胞谱系,而第二种条形码让我们可以计算每个起始细胞产生的细胞数量。这降低了噪音,因此我们可以确定每种gRNA对类器官生长过程中产生的细胞数量的影响。为了描述我们的方法,我们将之称为CRISPR-LICHT( CRIPSR-Lineage Tracing at Cellular resolution in Heterogenous Tissue,利用CRipsR在异质组织中进行细胞分辨率下的谱系追踪)。”
这些研究人员将CRISPR-LICHT应用于小头畸形(microcephaly),即一种以患者大脑尺寸缩小和严重智力障碍为典型特征的遗传性疾病。通过这种革命性的新技术,他们筛选出了所有疑似在这种疾病中发挥作用的基因。
10.Science:临床前研究显示母体可将过敏传递给后代
doi:10.1126/science.aba0864; doi:10.1126/science.abe8283
在一项新的研究中,来自新加坡科技研究局(A*STAR)、新加坡竹脚妇幼医院、杜克-新加坡国立大学医学院、新加坡国立大学、中国上海交通大学和美国杜克大学等研究机构的研究人员报告,母体可以在它们的后代在子宫内发育时将过敏传给后者。相关研究结果近期发 表在Science期刊上,论文标题为“Fetal mast cells mediate postnatal allergic responses dependent on maternal IgE”。
这项研究采用了符合新加坡国家实验动物研究咨询委员会(NACLAR)指南的动物模型,发现负责引发过敏反应的关键抗体--免疫球蛋白E(IgE)---可以穿过胎盘进入胎儿体内。当进入胎儿体内时,这种抗体会与胎儿肥大细胞结合,其中肥大细胞是一种免疫细胞,会释放 引发从流鼻涕到哮喘等过敏反应的化学物。出生后,新生小鼠在第一次接触过敏原时,会与它们的母体那样对相同类型的过敏原产生过敏反应,不同的是,成年小鼠需要两次接触过敏原才能产生过敏反应。实验室的研究还表明,母体IgE可以与人类胎儿肥大细胞结合,表 明它们可能以类似的方式穿过人类的胎盘。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


