冷凝集素病(CAD)溶血治疗药物!赛诺菲补体C1s抑制剂sutimlimab遭美国FDA拒绝批准!
来源:本站原创 2020-11-18 16:56
sutimlimab有潜力成为第一个治疗CAD溶血的药物。

2020年11月18日讯 /生物谷BIOON/ --赛诺菲(Sanofi)近日宣布,美国食品和药物管理局(FDA)已针对sutimlimab的生物制品许可申请(BLA)发布了一封完整回应函(CRL),该药是一种单克隆抗体,用于原发性冷凝集素病(CAD)成人患者治疗溶血。sutimlimab通过选择性抑制补体C1s来靶向CAD溶血的内在病因。
在CRL中,FDA指出在对负责制造的第三方设施进行批准前检查(Pre-license Inspection,PLI)时发现了某些缺陷。CRL中没有发现与申请相关的临床或安全性缺陷。在BLA获得批准之前,需要第三方制造商满意地解决CRL中提及的缺陷。赛诺菲将与FDA和第三方制造商保持密切联系,以便及时达成解决方案。
今年5月,FDA受理了sutimlimab的BLA并授予了优先审查。如果获得批准,sutimlimab将成为第一个也是唯一一个治疗CAD溶血的药物。此前,FDA已授予sutimlimab突破性药物资格(BTD)和孤儿药资格(ODD)。
CAD是一种罕见、严重、慢性、自身免疫性溶血性贫血疾病,在这种疾病中,免疫系统中的补体系统错误地攻击人体健康红细胞并导致红细胞破裂(溶血)。CAD患者可能会经历慢性贫血、严重疲劳、急性溶血危象和其他潜在的并发症,包括血栓栓塞事件和早期死亡的风险升高。据估计,在美国约有5000例CAD患者。
sutimlimab BLA的提交,基于在原发性CAD患者中开展的一项开放标签单臂关键III期CARDINAL研究的A部分(n=24)结果。这些数据已在2019年第61届美国血液学会年会(ASH2019)上公布,证实sutimlimab达到了主要复合疗效指标,该指标定义为达到所有如下复合标准的患者比例:在治疗评估时间点(23周、25周、26周的平均值)血红蛋白水平相对基线增加≥2g/dL或达到血红蛋白水平≥12g/dL、第5-26周期间没有输血。此外,试验表明,sutimlimab也达到了次要终点:显示疾病过程关键指标的改善,包括血红蛋白的改善、胆红素的正常化、慢性病治疗功能评估(FACIT)疲劳评分的改善。
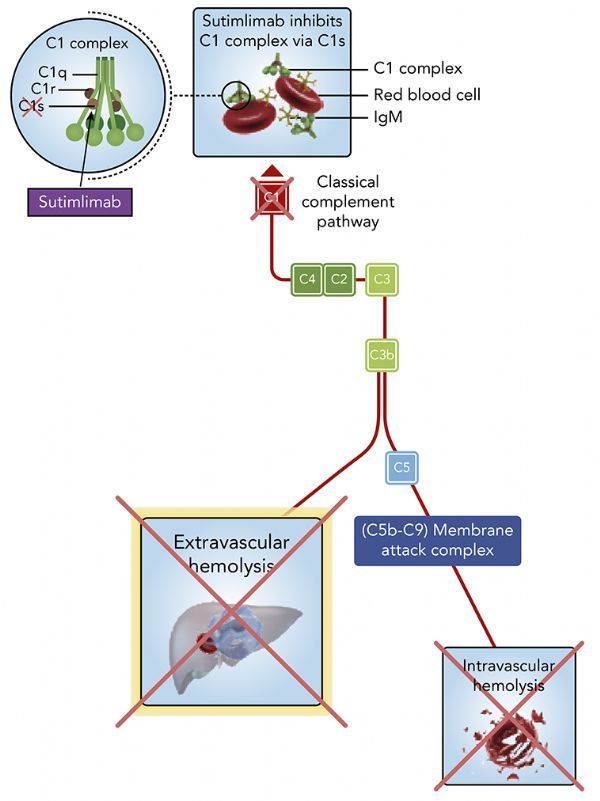
sutimlimab是一种潜在首创、研究性、人源化单克隆抗体,经专门设计用于选择性靶向和抑制C1复合物中的丝氨酸蛋白酶C1s,C1复合物是激活免疫系统经典补体途径的第一步。经典补体途径是先天免疫系统的一部分,其激活是CAD溶血的中心机制。通过靶向抑制C1s,sutimlimab据认为可阻断经典补体途径的激活,从而阻止CAD中的C1激活溶血的发生。
sutimlimab具有新颖的作用机制和高度的靶点特异性,可选择性地抑制疾病过程中经典补体途径的上游,同时保留完整的替代补体途径和凝集素补体途径及其免疫监视功能。
目前,赛诺菲正在III期CADENZA试验中评估sutimlimab用于近期未输血的CAD患者,该公司也正在调查sutimlimab用于治疗免疫性血小板减少性紫癜(ITP)患者。(生物谷Bioon.com)
原文出处:FDA issues Complete Response Letter for sutimlimab, an investigational treatment for hemolysis in adults with cold agglutinin disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


