CD123靶向疗法!美纳里尼Elzonris欧盟即将获批:治疗母细胞性浆细胞样树突细胞肿瘤(BPDCN)!
来源:本站原创 2020-11-17 15:26
Elzonris是一款靶向CD123的细胞毒素疗法,已获美国FDA批准。

2020年11月17日讯 /生物谷BIOON/ --美纳里尼集团(The Menarini Group)是一家私人持有的意大利制药和诊断公司。近日,该公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Elzonris(tagraxofusp),作为一种附加疗法,用于一线治疗母细胞性浆细胞样树突状细胞肿(BPDCN)成人患者。BPDCN是一种预后非常差的血液系统恶性肿瘤。CHMP的积极审查意见,基于在既往未接受治疗(初治)和既往已接受治疗(经治)的BPDCN患者中开展的有史以来最大规模的前瞻性临床试验。
现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者通常会在2个月内在做出最终审查决定。如果获批,Elzonris将成为欧洲第一个也是唯一一个治疗BPDCN的药物,也将成为欧洲第一个获批的CD123靶向疗法。
美纳里尼集团首席执行官Elcin Barker Ergun表示:“今天CHMP的积极意见,对欧洲的BPDCN患者来说是一个重要的里程碑,它表明了我们对改善难治癌症患者生活的坚定承诺。BPDCN是一种罕见的侵袭性疾病,目前在欧盟没有批准的治疗方案。出于这个原因,我们特别高兴能够向BPDCN患者提供Elzonris。”。
Elzonris是一款针对CD123的靶向疗法,由Stemline Therapeutics在美国首次商业化推出,该公司现隶属于美纳里尼集团。根据收购条款,Stemline股东获得了一项不可交易或有价值权(CVR),在欧盟委员会批准后,在任一欧盟5国完成首次Elzonris销售后,每位股东可获得每股1.00美元的现金。
Elzonris于2018年12月获得美国FDA批准,用于治疗2岁及以上的BPDCN儿童和成人患者,包括既往未接受治疗(初治)和既往已接受治疗(经治)的BPDNC患者。值得一提的是,此次批准,使Elzonris成为首个获批治疗BPDCN的药物,同时也是首个获得批准的CD123靶向药物。
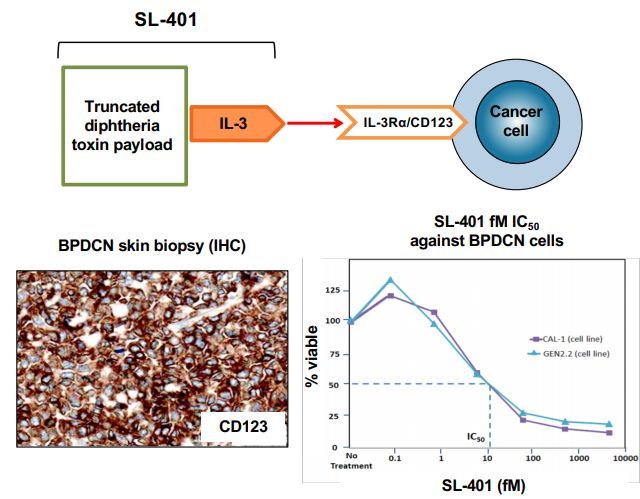
Elzonris(tagraxofusp)的作用机制(图片来源,Stemline公司网站)
BPDCN是一种侵袭性、罕见性血液系统恶性肿瘤,预后不佳,这是一个医疗需求未满足的治疗领域。BPDCN的特征可能与某些疾病相似,也可能被误诊为某些疾病,包括急性髓性白血病(AML)、非霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病(ALL)、骨髓增生异常综合症、慢性粒细胞性白血病(CML)以及其他具有皮肤表现的恶性肿瘤。BPDCN通常存在于骨髓和/或皮肤,也可能涉及淋巴结和内脏。BPDCN的诊断基于CD123、CD4、CD56的免疫诊断三联体。CD123(IL-3R)是识别BPDCN的一个关键标志物,并且是各种癌症治疗研究中的一个迅速出现的靶点。
Elzonris是一种CD123导向的细胞毒素,专门针对CD123靶点设计,该药由人IL-3与截短的白喉毒素(DT)进行重组融合而成,IL-3结构域能够将细胞毒性DT片段引导至表达CD123的肿瘤细胞。在被肿瘤细胞内化后,Elzonris能够不可逆地抑制蛋白质合成并诱导靶细胞凋亡。
目前,Elzonris也正在其他临床试验中进行评估,治疗其他CD123阳性适应症,包括:慢性骨髓单核细胞性白血病(CMML)、骨髓纤维化(MF)及其他计划的适应症。(生物谷Bioon.com)
原文出处:CHMP Adopted Positive Opinion for ELZONRIS (tagraxofusp), for the Treatment of Blastic Plasmacytoid Dendritic Cell Neoplasm (BPDCN)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


