近期肺癌相关研究进展一览
来源:本站原创 2020-10-26 22:52
本期为大家带来的是肺癌领域的最新研究进展,希望读者朋友们能够喜欢。
2020年10月26日 讯 /生物谷BIOON/ --本期为大家带来的是肺癌领域的最新研究进展,希望读者朋友们能够喜欢。
1. Nat Commun:科学家成功开发出一种深度学习模型工具 或有望更好地预测肺癌患者的治疗疗效
doi:10.1038/s41467-020-19116-x
在过去20年里,肺癌患者的个体化疗法的发展和选择已经取得了长足的进展,非小细胞肺癌依然是肺癌的主要类型,而且也是诱发全球癌症相关死亡的主要原因,对于这类肺癌而言目前有两种治疗性策略,即酪氨酸激酶抑制剂和免疫检查点抑制剂疗法,然而,为每一位非小细胞肺癌患者选择最正确的疗法或许并不是一件容易的事情,因为在其治疗过程中患者机体的生物标志物会发生变化从而导致疗法失效,为此,来自Moffitt癌症研究中心的科学家们就通过研究开发出了一种无创且准确的方法来分析患者机体中肿瘤的突变和生物标志物,从而就能帮助确定针对患者最佳的治疗手段。
相关研究结果发表在了国际杂志Nature Communications上,文章中,研究者阐明了如何利用深度学习模型,在正电子成象术/电脑断层摄影放射组学技术(PET/CT)的帮助下识别出哪些非小细胞肺癌患者对酪氨酸激酶疗法敏感,以及哪些患者能因免疫检查点抑制剂疗法的治疗而获益;该模型能利用放射性示踪元素18F-氟脱氧葡萄糖(18F-Fluorodeoxyglucose,一类糖分子)来进行PET/CT成像,利用18F-FDG PET/CT成像就能解释异常的葡萄糖代谢位点并帮助准确对患者机体的肿瘤进行特性分析。
研究者Matthew Schabath博士表示,这类名为18F-FDG PET/CT的成像技术被广泛用来确定非小细胞肺癌患者的疾病阶段,葡萄糖放射性示踪元素的使用常常会受到EGFR激活和患者机体炎症的影响,EGFR(表皮生长因子受体)是非小细胞肺癌患者机体最常见的突变,EGFR的突变状态被认为是患者疗法的预测子,携带活性EGFR突变的患者往往会对酪氨酸激酶疗法表现出较好的反应。
这项研究中,研究人员利用来自中国两家机构的非小细胞肺癌患者的回顾性数据,开发出了一种基于18F-FDG PET/CT的深度学习模型,这两家机构分别是上海肺科医院和河北医科大学附属第四医院,该模型能通过针对每一位患者产生EGFR深度学习得分来对患者机体的EGFR突变状态进行分类,一旦创建后,研究者就能利用另外两家机构患者的数据对该模型进行证实,另外这两家机构是哈尔滨医科大学附属第四医院和Moffitt癌症研究中心。
研究者Wei Mu说道,此前研究利用放射组学来作为非侵入性的手段预测患者机体的EGFR的突变状况,然而相比其它研究而言,我们的分析能够更加准确地预测患者机体EGFR的突变状况,同时还能产生很多优势,包括训练、证实以及对来自上述四家机构的多队列数据进行深度学习评分的检测,这或许就会增加该模型的通用性。
研究者发现,深度学习评分往往与酪氨酸激酶治疗患者较长的无进展生存率存在正相关关系,而与接受免疫检查点抑制剂免疫疗法患者的持久临床效益和较长的无进展生存期之间存在负相关关系,后期研究人员还希望进行更为深入的研究来证实这种新型模型的确能作为一种评估不同疗法的临床决策支持工具。
2.Oncotarget:新型microRNA或能靶向作用肺癌细胞中前列腺素E2的产生 有望帮助治疗肺癌!
DOI:10.18632/oncotarget.27614
近日,一项刊登在国际杂志Oncotarget上的研究报告中,来自罗格斯生物医学与健康科学研究所等机构的科学家们通过研究发现,高水平miR-708的表达与肺鳞状细胞癌患者的生存率直接相关,miR-708能通过抑制肺癌细胞中COX-2和mPGES-1的表达来抑制PGE2的产生。
此外,研究人员还发现,miR-708能降低肺癌细胞的增殖、生存和迁移,这部分归因于miR-708对PGE2信号的抑制作用;文章中,研究者还预测了新型的miR-708靶点以及肺癌中调节miR-708表达的调节子,相关研究结果表明,miR-708表达的失调或会促进PGE2的加速产生,从而就会增强肺癌细胞簇肿瘤表型的产生。
研究者Carol S. Lutz说道,肺癌是一种最常见的癌症类型,2018年全球有超过209万肺癌患者,更重要的是,肺癌也是全球人群中最具致死性的一种癌症类型,2018年大约有超过179万名肺癌相关的死亡病例。肺癌是多种不同亚型癌症的集合,其中非小细胞肺癌在所有肺部肿瘤中占到了85%的比例,miR-708还间接调节了参与PI3K信号、细胞周期进展、上皮-间充质转化和癌细胞干性表达等过程的基因的表达。
这项研究中,研究人员旨在解析新型的miR-708靶点,同时他们还想解决在肺癌中miR-708是否能作为致癌或肿瘤异质性的mi-RNA分子。后期研究者还将深入研究miR-708在肺癌发生中扮演的关键角色,其与此前的研究数据共同强调了miR-708在肺癌诊断中的潜在价值,以及潜在的治疗干预意义,尤其是针对肺鳞状细胞癌等。
研究者表示,本文研究揭示了miR-708通过靶向作用COX-2和mPGES-1的表达来抑制致癌PGE2产生的新型肿瘤抑制功能,相关研究结果对于识别新型的miR-708靶点、调节miR-708表达的调节子具有非常重要的意义;此外本文研究还指出,后期科学家们还需要深入理解肺癌的生物学特性,从而帮助改善肺癌的诊断和治疗,最终增加肺癌患者的生活质量和治疗预后。
3. Nat Commun: 潜在药物可治疗特定肺癌
DOI: 10.1038/s41467-020-18442-4
癌细胞异质性常常阻碍了癌症治疗的有效性。 EGFR突变的肺癌就是这种情况:基于一种称为酪氨酸激酶抑制剂(TKI)的药物已用于治疗该疾病,但治疗效果千差万别。有时,肿瘤细胞对这种药物具有简单的抗性。现在,金泽大学的Seiji Yano及其同事研究了TKI 药物奥西替尼治疗EGFR突变的肺癌的功效,以及其与肿瘤细胞中一种称为AXL的蛋白质表达的关系。他们发现,高表达和低表达AXL的肿瘤细胞均显示出对奥西替尼的耐受性(获得性耐药性),但在两种情况下涉及的机制不同。此外,研究人员提出了一种方法,可以提高AXL低表达量癌细胞在使用的奥西替尼治疗时的成功率。

首先,科学家在体外实验中比较了AXL高表达和低表达的肿瘤细胞对奥西替尼的敏感性。他们观察到,在两种情况下,奥西替尼均抑制癌细胞的生存能力,但对于AXL低表达的EGFR突变的肺癌细胞,对药物的敏感性更高。他们还注意到该过程中少量肿瘤细胞幸存下来,表明其具有奥西替尼耐受型。这些发现与较早对29名EGFR突变的非小细胞肺癌患者进行的药物临床研究结果一致。
通过旨在了解奥西替尼耐受性背后机制的实验,Yano和同事发现,在低表达AXL的肿瘤细胞系中,IGF-1R的磷酸化增加,而在高表达AXL的肿瘤中却没有。 IGF-1R即胰岛素样生长因子1受体;它是一种位于人体细胞表面的蛋白质。然后,研究人员发现磷酸化的IGF-1R促进了奥AXL低表达肿瘤在治疗后的存活。
然后,科学家测试了观察到的奥西替尼耐药性是否可以通过服用林西替尼来解决。林西替尼是一种已知能够抑制IGF-1R磷酸化的物质。在取得积极成果的鼓舞下,Yano和同事们评估了奥西替尼和林西替尼的组合。他们的结论是,林西替尼与持续奥西替尼的瞬时治疗可以治愈或至少显著延迟AXL低表达EGFR突变的肺癌的肿瘤复发。不过,还需要做更多的调查。”
4. NEJM:III期临床试验表明阿特朱单抗可显著延长表达PD-L1的非小细胞肺癌患者的生存期
doi:10.1056/NEJMoa1917346.
根据一项新的临床试验,对表达PD-L1的非小细胞肺癌(NSCLC)患者而言,阿特朱单抗(atezolizumab)治疗可导致比化疗更长的总生存期。相关研究结果发表在2020年10月1日的NEJM期刊上,论文标题为“Atezolizumab for First-Line Treatment of PD-L1–Selected Patients with NSCLC”。
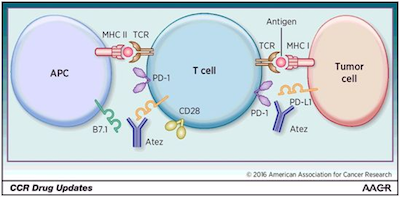
美国耶鲁大学医学院的Roy S. Herbst博士及其同事们进行一项开放标签的III期随机临床试验,涉及572名未接受化疗且有PD-L1表达的转移性非鳞状或鳞状NSCLC患者。患者以1:1的比例被随机分配接受阿特朱单抗治疗(下称阿特朱单抗治疗组)或化疗(下称化疗组)。
这些研究人员发现,在205名PD-L1表达量最高的EGFR和ALK野生型肿瘤患者中,阿特朱单抗治疗组的中位总生存期比化疗组长(前者为20.2个月,后者为13.1个月;死亡危险比为0.59)。在所有可以评估安全性的患者中,阿特朱单抗治疗组和化疗组分别有90.2%和94.7%的患者发生不良事件;3级和4级不良事件分别在30.1%和52.5%的患者中发生。在血型肿瘤突变负担较高的患者亚群中,阿特朱单抗治疗组的总生存期和无进展生存期均优于化疗组。
这些研究人员写道,“我们发现,在之前未经治疗的高表达PD-L1的转移性NSCLC患者中,阿特朱单抗单药治疗的总生存期比铂类联合化疗更长。”
这项临床研究由阿特朱单抗的制造商罗氏公司/基因泰克公司资助。
5. NEJM:临床试验表明药物selpercatinib有望治疗RET融合阳性非小细胞肺癌
doi:10.1056/NEJMe2024831.
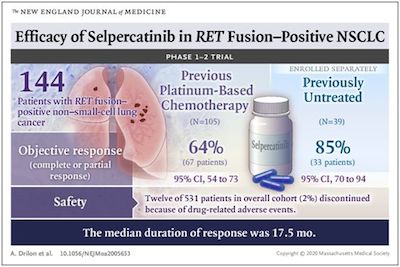
在一项新的1-2期临床研究中,一个国际研究团队发现,作为一种精确靶向由RET基因突变或改变驱动的癌症的药物,selpercatinib(又名LOXO-292)能有效缩小非小细胞肺癌(NSCLC)患者的肿瘤,大部分患者生活一年以上而没有疾病进展。在甲状腺癌中也观察到这种药物的抗癌活性。相关研究结果近期发表在NEJM期刊上,论文标题为“Efficacy of Selpercatinib in RET Fusion–Positive Non–Small-Cell Lung Cancer”。
非小细胞肺癌占所有肺癌的80%以上。从未吸烟的人所患的肺癌通常是非小细胞肺癌。这种疾病对女性的影响比男性更大。非小细胞肺癌的标准治疗是手术、化疗和放疗的综合治疗,没有靶向治疗方案。晚期非小细胞肺癌患者预后差,中位总生存率为12个月。
药物selpercatinib对既往未接受过抗癌药物治疗的患者和接受其他药物治疗后出现疾病进展的患者均有效。这项1-2期临床试验结果促使美国食品药品管理局(FDA)于2020年5月批准selpercatinib用于治疗:a)RET驱动的转移性非小细胞肺癌成年患者;b)12岁及以上的成人和儿童,患有需要系统治疗的晚期或转移性RET突变型甲状腺髓样癌;c)12岁及以上对放射性碘耐药的晚期或转移性RET融合阳性甲状腺癌患者。药物selpercatinib是首个获批的专门靶向由RET基因突变或改变驱动的癌症的药物。
RET相关癌症患者通常使用靶向在许多不同癌症类型中常见的RET和其他多种酶的药物进行治疗。然而,目前被批准用于治疗的多激酶抑制剂有副作用,这限制了它们在RET驱动的癌症患者中的使用。selpercatinib治疗的最常见副作用是高血压、肝酶水平升高、钠水平下降和白细胞计数低,这些副作用都是可以控制的。在531名参加这项临床试验的患者中,只有12名患者因为副作用而不得不停止治疗。
论文共同第一作者、新加坡国立癌症中心临床试验与流行病学部副主任Daniel Tan临床副教授说,“这项临床试验显示,这种靶向药物具有良好的疗效,反应强烈、持续,副作用少。这也证明了分子表达谱(molecular profiling)的重要性,新加坡国立癌症中心已经对所有肺癌患者实施了RET基因的常规检测,从而使得这部分患者能够从这种靶向治疗中获益。”
在这项临床试验中,64%之前接受过治疗的患者获得了客观反应,63%的患者在1年后仍有反应。85%之前未接受治疗的患者实现了客观反应,反应期中位数为17.5个月。
新加坡国立癌症中心医疗总监William Hwang教授说,“这种靶向治疗将为非小细胞肺癌患者提供显著改善的健康结果。新加坡国立癌症中心很高兴能参与这项临床试验,为患者找到精准的肿瘤治疗方案。这凸显了新加坡国立癌症中心的实验性癌症治疗部(Experimental Cancer Therapeutics Unit, ECRU)在运行具有影响力的可以确定新治疗标准的早期临床试验中发挥着重要作用。”
这项临床试验有来自美国、加拿大、法国、瑞士、德国、西班牙、澳大利亚和新加坡等12个国家的65家全球领先的癌症中心参与。该临床试验得到了礼来公司的全资子公司Loxo Oncology的支持。
在新加坡,这项临床试验由新加坡国立癌症中心的实验性癌症治疗部领导,该实验性癌症治疗部支持从0期到2期的早期临床试验。这个跨学科团队从事针对所有实体瘤和淋巴瘤的抗癌新药的临床前和临床开发,以便给患者提供新的治疗选择,并在新加坡国立癌症中心率先开展了精准肿瘤学项目IMPACT(Individualised Molecular Profiling for Allocation to Clinical Trials),至今已招募了1500多名患者。
6. Cancer Res:抑制SHP2信号可克服肺癌细胞耐药性
DOI: 10.1158/0008-5472.CAN-12-1944
来自德克萨斯大学MD安德森癌症中心和BridgeBio Pharma,Inc.附属公司Navire Pharma,Inc.的新的临床前研究发现,新型SHP2抑制剂IACS-13909能够克服非小细胞肺癌的多种治疗耐药机制(NSCLC),这表明一种可能的新方法可用于治疗已对靶向EGFR抑制剂奥西替尼产生抗药性的癌症。
该数据今天发表在美国癌症研究协会期刊《Cancer Research》上。 IACS-13909是由Navire和MD Anderson的Therapeutics Discovery部门合作开发的有效且选择性的变构SHP2(含Src同源2域的磷酸酶)抑制剂。基于这些数据,Navire计划在2020年底之前在包括MD Anderson在内的多个美国地点开展SHP2抑制剂的临床研究。
IACS-13909最初是由MD安德森应用癌症科学研究所(IACS)和转化研究促进肿瘤治疗和创新平台(TRACTION)平台上的科学家团队发现的。
该研究的资深作者,Nancy Kohl博士说:“酪氨酸激酶抑制剂(如奥西替尼)起初似乎可以有效地抑制肿瘤的生长,但是当患者仍在接受治疗时,会产生多种耐药机制。这项研究表明,IACS-13909抑制多种信号通路下游蛋白的能力是克服这些常见的肿瘤耐药机制的有前途的方法。”
Osimertinib是一种靶向EGFR抑制剂,被用作治疗具有特定EGFR突变的NSCLC患者的一线选择。但是,NSLC经常会随着时间的推移而发展出奥西替尼耐药性,这可能是通过阻止药物活性的EGFR突变引起的,或者是通过激活了补偿性信号通路。
SHP2是一种在这些途径下游发挥作用的蛋白质,它是MAPK信号传导途径的完全激活所必需的,众所周知,MAPK信号传导途径可促进肿瘤的生长,增殖和存活。
首席作者Yuting Sun博士说:“我们的发现表明,对于携带多种活化激酶作为致癌驱动因子的肺癌,IACS-13909能够在体外抑制肿瘤细胞增殖并在体内引起肿瘤消退。这些数据表明,靶向SHP2可以为克服通过多种机制发生的奥西替尼耐药性提供可行的策略。”
当IACS-13909用作单一药物并与osimertinib体内联合使用时,这些结果是一致的。体外联合治疗在对奥西替尼敏感的肿瘤中导致延长的,更持久的反应,并在奥西替尼耐药模型中刺激肿瘤消退。
7. Cell Stem Cell:新型类器官平台或能加速早期肺癌的研究 有望帮助开发新型潜在的靶向性疗法
doi:10.1016/j.stem.2020.07.022
近日,一项刊登在国际杂志Cell Stem Cell上的研究报告中,来自哈佛医学院等机构的科学家们通过研究开发了一种新型加速平台,其或用来研究早期阶段的肺癌并能识别和检测潜在的新型疗法,即利用衍生自肺部细胞的类器官来深入开展研究。研究者指出,类器官能帮助他们追踪一种常见且难以研究的肺部肿瘤—肺腺癌(adenocarcinoma),其是由KRAS基因突变所驱动的,同时研究人员还能捕捉到肿瘤进展过程中所发生的分子改变。
肺癌是引发美国人群死亡的主要原因,在早期阶段人们常常会忽略该疾病,尽管近年来的成像技术使得对肺癌的早期诊断成为了可能,但对于早期肺癌而言,目前研究人员仍然没有针对性的疗法。这项研究中,研究人员利用了四种早期肺癌的平行模型进行研究,即来自于1A阶段肺癌患者的肿瘤样本、遗传修饰的小鼠模型、衍生自小鼠肺部干细胞或来自人类诱导多能干细胞所产生的肺部细胞的肺部类器官。
研究者Kim说道,我们对将正常肺部上皮细胞转化为癌细胞的早期事件知之甚少,文章中,我们利用来自肺癌患者机体的早期阶段样本进行研究发现,类器官能真正模拟早期疾病阶段患者机体所发生的事件,同时在7天内研究者就能从类器官中观察到这些改变,而这在小鼠或人类患者机体中往往需要数月甚至更长时间。
随后研究人员将诱发癌症的KRAS突变引入到肺部类器官的肺泡祖细胞中,并利用单细胞RNA测序技术来观察哪些基因能够开启表达;相关研究结果表明,作为成熟肺泡上皮细胞标志物的基因的表达水平下降了,而参与早期肺部发育的基因的表达水平却增强了(这些基因被认为是癌症进展的标志物);对小鼠和患者肿瘤样本的研究或许就印证了在类器官中的发现。
KRAS突变的肿瘤通常会对疗法产生一定耐药性,本文研究或为研究人员提供了一种新思路来寻找有效治疗耐药性癌症的新疗法;尽管本文研究重点观察了KRAS驱动的肺癌类型,但研究者认为,这种类器官的策略或能促进对多种类型癌症的研究,包括对候选药物的检测等。最后研究者表示,后期他们希望能对早期肺癌形成的新型人类和肺部类器官模型进行研究来助力强大的药物研发平台帮助开发新型肺癌治疗药物。
8. PNAS:治疗KRAS突变型肺癌的新疗法
DOI: 10.1073/pnas.2002520117
KRAS是一类常见的致癌基因,至少参与了所有人类癌症的五分之一。KRAS突变导致32%的肺肿瘤和96%的胰腺肿瘤。然而,经过三十多年的研究,至今仍没有针对这种癌基因的有效治疗策略。由于这个原因,进行的许多研究都试图鉴定出沿KRAS信号通路显示出治疗活性的其他分子。面对这一挑战,西班牙国家癌症研究中心(CNIO)实验肿瘤小组的研究人员发现:CDK4和RAF1基因的失活会导致该KRAS基因突变小鼠中诱发的25%的肺肿瘤完全缓解。这一发现已最近发表在《PNAS》杂志上。

该研究中,CNIO团队探索了一种方法,该方法包括灭活KRAS信号通路中的两个基因:CDK4和RAF1。即便如此,正如在临床实践中经常发现的那样,一定比例的肿瘤在没有CDK4和RAF1的情况下仍能够存活。但是,研究人员进一步确定了引发这种抗药性并阻止肿瘤缓解的分子机制——PI3K途径的激活,以及通过甲基化使几种抑癌基因沉默。主要作者Laura de Esteban解释说:“两种机制都可以在治疗上中和:一方面使用PI3K抑制剂,另一方面通过肿瘤抑制基因的选择性去甲基化来重新激活其功能。” 。
为了进行这项研究,CNIO小组使用了一种小鼠模型,该模型可以准确地重现人类疾病,并通过激活KRAS癌基因和失活p53抑癌基因来诱导侵袭性肺肿瘤。
这些发现为开发具有KRAS突变的肿瘤的新疗法提供了启示,并表明开发专门针对RAF1的抑制剂的重要性。此外,作者还指出,未来将要进行的另一研究领域是对灭活治疗靶标后可能出现的多种耐药途径的研究。
9. J Thorac Oncol:研究揭示杀伤肺癌细胞的关键免疫细胞
DOI: 10.1016/j.jtho.2020.05.008
在最近一项研究中,澳大利亚Walter and Eliza Hall Institute研究人员揭示了 NK细胞抵抗肺癌的分子机制。
在研究小细胞肺癌(SCLC)的临床前和患者样本后发现,NK细胞(而非T细胞)对于减缓癌症的侵袭性扩散至关重要。 NK细胞的“增压”进一步增强了它们的抗癌能力。这一发现为SCLC患者提供了更好的治疗方法的希望。
这项研究由Walter和Eliza Hall研究所的研究人员Sarah Best博士,Jonas Hess先生和Kate Sutherland博士与Melissa Davis副教授和Nick Huntington教授(现为Monash Biomedicine)合作完成。
NK和T细胞是可以抵抗癌症的免疫细胞,研究人员表明NK和T细胞可浸润某些SCLC(一种侵袭性肺癌)患者的肿瘤。临床前模型显示,NK细胞(而非T细胞)对于限制SCLC扩散至关重要,并且“增压” NK细胞可增强其有效性。这些发现表明,利用NK细胞的免疫疗法可能是SCLC的有效疗法。
SCLC是最具侵略性的肺癌类型,通常在疾病开始扩散或转移后才被发现。 Best博士说,尽管SCLC患者最初将从化疗中受益,但这些癌症会迅速产生耐药性,平均患者生存期仅为数月。 “ 细胞不是唯一的抗癌免疫细胞,NK细胞也可以攻击肿瘤细胞。因此,我们决定研究哪种免疫疗法对SCLC患者最有希望。”
该团队首先研究了患者SCLC样品中的抗癌免疫标志物。“分析表明,患者体内肿瘤内NK和T细胞相对含量的差异很大。肿瘤中这些细胞的存在表明正在进行抗癌反应。”
为了了解NK或T细胞是否能减缓SCLC的扩散,研究小组研究了缺乏NK或T细胞的疾病的实验模型。 “我们发现NK细胞的缺失使SCLC肿瘤扩散得更多,而T细胞的缺失并没有影响疾病的扩散。这表明NK细胞而非T细胞对限制SCLC的转移很重要。如果我们通过添加细胞因子IL-15激活NK细胞,它们在限制SCLC扩散方面的能力甚至会更好。 激活T细胞和NK细胞进一步减少了SCLC的扩散,表明这两种细胞可以协同工作。”
“我们的研究表明,利用NK细胞的抗肿瘤能力的免疫疗法可能对SCLC更有效。我们认为基于NK细胞的免疫疗法可能是化疗的有效补充,可以减缓疾病的传播并延长SCLC患者的生存期。”(生物谷Bioon.com)
1. Nat Commun:科学家成功开发出一种深度学习模型工具 或有望更好地预测肺癌患者的治疗疗效
doi:10.1038/s41467-020-19116-x
在过去20年里,肺癌患者的个体化疗法的发展和选择已经取得了长足的进展,非小细胞肺癌依然是肺癌的主要类型,而且也是诱发全球癌症相关死亡的主要原因,对于这类肺癌而言目前有两种治疗性策略,即酪氨酸激酶抑制剂和免疫检查点抑制剂疗法,然而,为每一位非小细胞肺癌患者选择最正确的疗法或许并不是一件容易的事情,因为在其治疗过程中患者机体的生物标志物会发生变化从而导致疗法失效,为此,来自Moffitt癌症研究中心的科学家们就通过研究开发出了一种无创且准确的方法来分析患者机体中肿瘤的突变和生物标志物,从而就能帮助确定针对患者最佳的治疗手段。

相关研究结果发表在了国际杂志Nature Communications上,文章中,研究者阐明了如何利用深度学习模型,在正电子成象术/电脑断层摄影放射组学技术(PET/CT)的帮助下识别出哪些非小细胞肺癌患者对酪氨酸激酶疗法敏感,以及哪些患者能因免疫检查点抑制剂疗法的治疗而获益;该模型能利用放射性示踪元素18F-氟脱氧葡萄糖(18F-Fluorodeoxyglucose,一类糖分子)来进行PET/CT成像,利用18F-FDG PET/CT成像就能解释异常的葡萄糖代谢位点并帮助准确对患者机体的肿瘤进行特性分析。
研究者Matthew Schabath博士表示,这类名为18F-FDG PET/CT的成像技术被广泛用来确定非小细胞肺癌患者的疾病阶段,葡萄糖放射性示踪元素的使用常常会受到EGFR激活和患者机体炎症的影响,EGFR(表皮生长因子受体)是非小细胞肺癌患者机体最常见的突变,EGFR的突变状态被认为是患者疗法的预测子,携带活性EGFR突变的患者往往会对酪氨酸激酶疗法表现出较好的反应。
这项研究中,研究人员利用来自中国两家机构的非小细胞肺癌患者的回顾性数据,开发出了一种基于18F-FDG PET/CT的深度学习模型,这两家机构分别是上海肺科医院和河北医科大学附属第四医院,该模型能通过针对每一位患者产生EGFR深度学习得分来对患者机体的EGFR突变状态进行分类,一旦创建后,研究者就能利用另外两家机构患者的数据对该模型进行证实,另外这两家机构是哈尔滨医科大学附属第四医院和Moffitt癌症研究中心。
研究者Wei Mu说道,此前研究利用放射组学来作为非侵入性的手段预测患者机体的EGFR的突变状况,然而相比其它研究而言,我们的分析能够更加准确地预测患者机体EGFR的突变状况,同时还能产生很多优势,包括训练、证实以及对来自上述四家机构的多队列数据进行深度学习评分的检测,这或许就会增加该模型的通用性。
研究者发现,深度学习评分往往与酪氨酸激酶治疗患者较长的无进展生存率存在正相关关系,而与接受免疫检查点抑制剂免疫疗法患者的持久临床效益和较长的无进展生存期之间存在负相关关系,后期研究人员还希望进行更为深入的研究来证实这种新型模型的确能作为一种评估不同疗法的临床决策支持工具。
2.Oncotarget:新型microRNA或能靶向作用肺癌细胞中前列腺素E2的产生 有望帮助治疗肺癌!
DOI:10.18632/oncotarget.27614
近日,一项刊登在国际杂志Oncotarget上的研究报告中,来自罗格斯生物医学与健康科学研究所等机构的科学家们通过研究发现,高水平miR-708的表达与肺鳞状细胞癌患者的生存率直接相关,miR-708能通过抑制肺癌细胞中COX-2和mPGES-1的表达来抑制PGE2的产生。

此外,研究人员还发现,miR-708能降低肺癌细胞的增殖、生存和迁移,这部分归因于miR-708对PGE2信号的抑制作用;文章中,研究者还预测了新型的miR-708靶点以及肺癌中调节miR-708表达的调节子,相关研究结果表明,miR-708表达的失调或会促进PGE2的加速产生,从而就会增强肺癌细胞簇肿瘤表型的产生。
研究者Carol S. Lutz说道,肺癌是一种最常见的癌症类型,2018年全球有超过209万肺癌患者,更重要的是,肺癌也是全球人群中最具致死性的一种癌症类型,2018年大约有超过179万名肺癌相关的死亡病例。肺癌是多种不同亚型癌症的集合,其中非小细胞肺癌在所有肺部肿瘤中占到了85%的比例,miR-708还间接调节了参与PI3K信号、细胞周期进展、上皮-间充质转化和癌细胞干性表达等过程的基因的表达。
这项研究中,研究人员旨在解析新型的miR-708靶点,同时他们还想解决在肺癌中miR-708是否能作为致癌或肿瘤异质性的mi-RNA分子。后期研究者还将深入研究miR-708在肺癌发生中扮演的关键角色,其与此前的研究数据共同强调了miR-708在肺癌诊断中的潜在价值,以及潜在的治疗干预意义,尤其是针对肺鳞状细胞癌等。
研究者表示,本文研究揭示了miR-708通过靶向作用COX-2和mPGES-1的表达来抑制致癌PGE2产生的新型肿瘤抑制功能,相关研究结果对于识别新型的miR-708靶点、调节miR-708表达的调节子具有非常重要的意义;此外本文研究还指出,后期科学家们还需要深入理解肺癌的生物学特性,从而帮助改善肺癌的诊断和治疗,最终增加肺癌患者的生活质量和治疗预后。
3. Nat Commun: 潜在药物可治疗特定肺癌
DOI: 10.1038/s41467-020-18442-4
癌细胞异质性常常阻碍了癌症治疗的有效性。 EGFR突变的肺癌就是这种情况:基于一种称为酪氨酸激酶抑制剂(TKI)的药物已用于治疗该疾病,但治疗效果千差万别。有时,肿瘤细胞对这种药物具有简单的抗性。现在,金泽大学的Seiji Yano及其同事研究了TKI 药物奥西替尼治疗EGFR突变的肺癌的功效,以及其与肿瘤细胞中一种称为AXL的蛋白质表达的关系。他们发现,高表达和低表达AXL的肿瘤细胞均显示出对奥西替尼的耐受性(获得性耐药性),但在两种情况下涉及的机制不同。此外,研究人员提出了一种方法,可以提高AXL低表达量癌细胞在使用的奥西替尼治疗时的成功率。

首先,科学家在体外实验中比较了AXL高表达和低表达的肿瘤细胞对奥西替尼的敏感性。他们观察到,在两种情况下,奥西替尼均抑制癌细胞的生存能力,但对于AXL低表达的EGFR突变的肺癌细胞,对药物的敏感性更高。他们还注意到该过程中少量肿瘤细胞幸存下来,表明其具有奥西替尼耐受型。这些发现与较早对29名EGFR突变的非小细胞肺癌患者进行的药物临床研究结果一致。
通过旨在了解奥西替尼耐受性背后机制的实验,Yano和同事发现,在低表达AXL的肿瘤细胞系中,IGF-1R的磷酸化增加,而在高表达AXL的肿瘤中却没有。 IGF-1R即胰岛素样生长因子1受体;它是一种位于人体细胞表面的蛋白质。然后,研究人员发现磷酸化的IGF-1R促进了奥AXL低表达肿瘤在治疗后的存活。
然后,科学家测试了观察到的奥西替尼耐药性是否可以通过服用林西替尼来解决。林西替尼是一种已知能够抑制IGF-1R磷酸化的物质。在取得积极成果的鼓舞下,Yano和同事们评估了奥西替尼和林西替尼的组合。他们的结论是,林西替尼与持续奥西替尼的瞬时治疗可以治愈或至少显著延迟AXL低表达EGFR突变的肺癌的肿瘤复发。不过,还需要做更多的调查。”
4. NEJM:III期临床试验表明阿特朱单抗可显著延长表达PD-L1的非小细胞肺癌患者的生存期
doi:10.1056/NEJMoa1917346.
根据一项新的临床试验,对表达PD-L1的非小细胞肺癌(NSCLC)患者而言,阿特朱单抗(atezolizumab)治疗可导致比化疗更长的总生存期。相关研究结果发表在2020年10月1日的NEJM期刊上,论文标题为“Atezolizumab for First-Line Treatment of PD-L1–Selected Patients with NSCLC”。

美国耶鲁大学医学院的Roy S. Herbst博士及其同事们进行一项开放标签的III期随机临床试验,涉及572名未接受化疗且有PD-L1表达的转移性非鳞状或鳞状NSCLC患者。患者以1:1的比例被随机分配接受阿特朱单抗治疗(下称阿特朱单抗治疗组)或化疗(下称化疗组)。
这些研究人员发现,在205名PD-L1表达量最高的EGFR和ALK野生型肿瘤患者中,阿特朱单抗治疗组的中位总生存期比化疗组长(前者为20.2个月,后者为13.1个月;死亡危险比为0.59)。在所有可以评估安全性的患者中,阿特朱单抗治疗组和化疗组分别有90.2%和94.7%的患者发生不良事件;3级和4级不良事件分别在30.1%和52.5%的患者中发生。在血型肿瘤突变负担较高的患者亚群中,阿特朱单抗治疗组的总生存期和无进展生存期均优于化疗组。
这些研究人员写道,“我们发现,在之前未经治疗的高表达PD-L1的转移性NSCLC患者中,阿特朱单抗单药治疗的总生存期比铂类联合化疗更长。”
这项临床研究由阿特朱单抗的制造商罗氏公司/基因泰克公司资助。
5. NEJM:临床试验表明药物selpercatinib有望治疗RET融合阳性非小细胞肺癌
doi:10.1056/NEJMe2024831.
在一项新的1-2期临床研究中,一个国际研究团队发现,作为一种精确靶向由RET基因突变或改变驱动的癌症的药物,selpercatinib(又名LOXO-292)能有效缩小非小细胞肺癌(NSCLC)患者的肿瘤,大部分患者生活一年以上而没有疾病进展。在甲状腺癌中也观察到这种药物的抗癌活性。相关研究结果近期发表在NEJM期刊上,论文标题为“Efficacy of Selpercatinib in RET Fusion–Positive Non–Small-Cell Lung Cancer”。

非小细胞肺癌占所有肺癌的80%以上。从未吸烟的人所患的肺癌通常是非小细胞肺癌。这种疾病对女性的影响比男性更大。非小细胞肺癌的标准治疗是手术、化疗和放疗的综合治疗,没有靶向治疗方案。晚期非小细胞肺癌患者预后差,中位总生存率为12个月。
药物selpercatinib对既往未接受过抗癌药物治疗的患者和接受其他药物治疗后出现疾病进展的患者均有效。这项1-2期临床试验结果促使美国食品药品管理局(FDA)于2020年5月批准selpercatinib用于治疗:a)RET驱动的转移性非小细胞肺癌成年患者;b)12岁及以上的成人和儿童,患有需要系统治疗的晚期或转移性RET突变型甲状腺髓样癌;c)12岁及以上对放射性碘耐药的晚期或转移性RET融合阳性甲状腺癌患者。药物selpercatinib是首个获批的专门靶向由RET基因突变或改变驱动的癌症的药物。
RET相关癌症患者通常使用靶向在许多不同癌症类型中常见的RET和其他多种酶的药物进行治疗。然而,目前被批准用于治疗的多激酶抑制剂有副作用,这限制了它们在RET驱动的癌症患者中的使用。selpercatinib治疗的最常见副作用是高血压、肝酶水平升高、钠水平下降和白细胞计数低,这些副作用都是可以控制的。在531名参加这项临床试验的患者中,只有12名患者因为副作用而不得不停止治疗。
论文共同第一作者、新加坡国立癌症中心临床试验与流行病学部副主任Daniel Tan临床副教授说,“这项临床试验显示,这种靶向药物具有良好的疗效,反应强烈、持续,副作用少。这也证明了分子表达谱(molecular profiling)的重要性,新加坡国立癌症中心已经对所有肺癌患者实施了RET基因的常规检测,从而使得这部分患者能够从这种靶向治疗中获益。”
在这项临床试验中,64%之前接受过治疗的患者获得了客观反应,63%的患者在1年后仍有反应。85%之前未接受治疗的患者实现了客观反应,反应期中位数为17.5个月。
新加坡国立癌症中心医疗总监William Hwang教授说,“这种靶向治疗将为非小细胞肺癌患者提供显著改善的健康结果。新加坡国立癌症中心很高兴能参与这项临床试验,为患者找到精准的肿瘤治疗方案。这凸显了新加坡国立癌症中心的实验性癌症治疗部(Experimental Cancer Therapeutics Unit, ECRU)在运行具有影响力的可以确定新治疗标准的早期临床试验中发挥着重要作用。”
这项临床试验有来自美国、加拿大、法国、瑞士、德国、西班牙、澳大利亚和新加坡等12个国家的65家全球领先的癌症中心参与。该临床试验得到了礼来公司的全资子公司Loxo Oncology的支持。
在新加坡,这项临床试验由新加坡国立癌症中心的实验性癌症治疗部领导,该实验性癌症治疗部支持从0期到2期的早期临床试验。这个跨学科团队从事针对所有实体瘤和淋巴瘤的抗癌新药的临床前和临床开发,以便给患者提供新的治疗选择,并在新加坡国立癌症中心率先开展了精准肿瘤学项目IMPACT(Individualised Molecular Profiling for Allocation to Clinical Trials),至今已招募了1500多名患者。
6. Cancer Res:抑制SHP2信号可克服肺癌细胞耐药性
DOI: 10.1158/0008-5472.CAN-12-1944
来自德克萨斯大学MD安德森癌症中心和BridgeBio Pharma,Inc.附属公司Navire Pharma,Inc.的新的临床前研究发现,新型SHP2抑制剂IACS-13909能够克服非小细胞肺癌的多种治疗耐药机制(NSCLC),这表明一种可能的新方法可用于治疗已对靶向EGFR抑制剂奥西替尼产生抗药性的癌症。
该数据今天发表在美国癌症研究协会期刊《Cancer Research》上。 IACS-13909是由Navire和MD Anderson的Therapeutics Discovery部门合作开发的有效且选择性的变构SHP2(含Src同源2域的磷酸酶)抑制剂。基于这些数据,Navire计划在2020年底之前在包括MD Anderson在内的多个美国地点开展SHP2抑制剂的临床研究。

IACS-13909最初是由MD安德森应用癌症科学研究所(IACS)和转化研究促进肿瘤治疗和创新平台(TRACTION)平台上的科学家团队发现的。
该研究的资深作者,Nancy Kohl博士说:“酪氨酸激酶抑制剂(如奥西替尼)起初似乎可以有效地抑制肿瘤的生长,但是当患者仍在接受治疗时,会产生多种耐药机制。这项研究表明,IACS-13909抑制多种信号通路下游蛋白的能力是克服这些常见的肿瘤耐药机制的有前途的方法。”
Osimertinib是一种靶向EGFR抑制剂,被用作治疗具有特定EGFR突变的NSCLC患者的一线选择。但是,NSLC经常会随着时间的推移而发展出奥西替尼耐药性,这可能是通过阻止药物活性的EGFR突变引起的,或者是通过激活了补偿性信号通路。
SHP2是一种在这些途径下游发挥作用的蛋白质,它是MAPK信号传导途径的完全激活所必需的,众所周知,MAPK信号传导途径可促进肿瘤的生长,增殖和存活。
首席作者Yuting Sun博士说:“我们的发现表明,对于携带多种活化激酶作为致癌驱动因子的肺癌,IACS-13909能够在体外抑制肿瘤细胞增殖并在体内引起肿瘤消退。这些数据表明,靶向SHP2可以为克服通过多种机制发生的奥西替尼耐药性提供可行的策略。”
当IACS-13909用作单一药物并与osimertinib体内联合使用时,这些结果是一致的。体外联合治疗在对奥西替尼敏感的肿瘤中导致延长的,更持久的反应,并在奥西替尼耐药模型中刺激肿瘤消退。
7. Cell Stem Cell:新型类器官平台或能加速早期肺癌的研究 有望帮助开发新型潜在的靶向性疗法
doi:10.1016/j.stem.2020.07.022
近日,一项刊登在国际杂志Cell Stem Cell上的研究报告中,来自哈佛医学院等机构的科学家们通过研究开发了一种新型加速平台,其或用来研究早期阶段的肺癌并能识别和检测潜在的新型疗法,即利用衍生自肺部细胞的类器官来深入开展研究。研究者指出,类器官能帮助他们追踪一种常见且难以研究的肺部肿瘤—肺腺癌(adenocarcinoma),其是由KRAS基因突变所驱动的,同时研究人员还能捕捉到肿瘤进展过程中所发生的分子改变。

肺癌是引发美国人群死亡的主要原因,在早期阶段人们常常会忽略该疾病,尽管近年来的成像技术使得对肺癌的早期诊断成为了可能,但对于早期肺癌而言,目前研究人员仍然没有针对性的疗法。这项研究中,研究人员利用了四种早期肺癌的平行模型进行研究,即来自于1A阶段肺癌患者的肿瘤样本、遗传修饰的小鼠模型、衍生自小鼠肺部干细胞或来自人类诱导多能干细胞所产生的肺部细胞的肺部类器官。
研究者Kim说道,我们对将正常肺部上皮细胞转化为癌细胞的早期事件知之甚少,文章中,我们利用来自肺癌患者机体的早期阶段样本进行研究发现,类器官能真正模拟早期疾病阶段患者机体所发生的事件,同时在7天内研究者就能从类器官中观察到这些改变,而这在小鼠或人类患者机体中往往需要数月甚至更长时间。
随后研究人员将诱发癌症的KRAS突变引入到肺部类器官的肺泡祖细胞中,并利用单细胞RNA测序技术来观察哪些基因能够开启表达;相关研究结果表明,作为成熟肺泡上皮细胞标志物的基因的表达水平下降了,而参与早期肺部发育的基因的表达水平却增强了(这些基因被认为是癌症进展的标志物);对小鼠和患者肿瘤样本的研究或许就印证了在类器官中的发现。
KRAS突变的肿瘤通常会对疗法产生一定耐药性,本文研究或为研究人员提供了一种新思路来寻找有效治疗耐药性癌症的新疗法;尽管本文研究重点观察了KRAS驱动的肺癌类型,但研究者认为,这种类器官的策略或能促进对多种类型癌症的研究,包括对候选药物的检测等。最后研究者表示,后期他们希望能对早期肺癌形成的新型人类和肺部类器官模型进行研究来助力强大的药物研发平台帮助开发新型肺癌治疗药物。
8. PNAS:治疗KRAS突变型肺癌的新疗法
DOI: 10.1073/pnas.2002520117
KRAS是一类常见的致癌基因,至少参与了所有人类癌症的五分之一。KRAS突变导致32%的肺肿瘤和96%的胰腺肿瘤。然而,经过三十多年的研究,至今仍没有针对这种癌基因的有效治疗策略。由于这个原因,进行的许多研究都试图鉴定出沿KRAS信号通路显示出治疗活性的其他分子。面对这一挑战,西班牙国家癌症研究中心(CNIO)实验肿瘤小组的研究人员发现:CDK4和RAF1基因的失活会导致该KRAS基因突变小鼠中诱发的25%的肺肿瘤完全缓解。这一发现已最近发表在《PNAS》杂志上。

该研究中,CNIO团队探索了一种方法,该方法包括灭活KRAS信号通路中的两个基因:CDK4和RAF1。即便如此,正如在临床实践中经常发现的那样,一定比例的肿瘤在没有CDK4和RAF1的情况下仍能够存活。但是,研究人员进一步确定了引发这种抗药性并阻止肿瘤缓解的分子机制——PI3K途径的激活,以及通过甲基化使几种抑癌基因沉默。主要作者Laura de Esteban解释说:“两种机制都可以在治疗上中和:一方面使用PI3K抑制剂,另一方面通过肿瘤抑制基因的选择性去甲基化来重新激活其功能。” 。
为了进行这项研究,CNIO小组使用了一种小鼠模型,该模型可以准确地重现人类疾病,并通过激活KRAS癌基因和失活p53抑癌基因来诱导侵袭性肺肿瘤。
这些发现为开发具有KRAS突变的肿瘤的新疗法提供了启示,并表明开发专门针对RAF1的抑制剂的重要性。此外,作者还指出,未来将要进行的另一研究领域是对灭活治疗靶标后可能出现的多种耐药途径的研究。
9. J Thorac Oncol:研究揭示杀伤肺癌细胞的关键免疫细胞
DOI: 10.1016/j.jtho.2020.05.008
在最近一项研究中,澳大利亚Walter and Eliza Hall Institute研究人员揭示了 NK细胞抵抗肺癌的分子机制。
在研究小细胞肺癌(SCLC)的临床前和患者样本后发现,NK细胞(而非T细胞)对于减缓癌症的侵袭性扩散至关重要。 NK细胞的“增压”进一步增强了它们的抗癌能力。这一发现为SCLC患者提供了更好的治疗方法的希望。

这项研究由Walter和Eliza Hall研究所的研究人员Sarah Best博士,Jonas Hess先生和Kate Sutherland博士与Melissa Davis副教授和Nick Huntington教授(现为Monash Biomedicine)合作完成。
NK和T细胞是可以抵抗癌症的免疫细胞,研究人员表明NK和T细胞可浸润某些SCLC(一种侵袭性肺癌)患者的肿瘤。临床前模型显示,NK细胞(而非T细胞)对于限制SCLC扩散至关重要,并且“增压” NK细胞可增强其有效性。这些发现表明,利用NK细胞的免疫疗法可能是SCLC的有效疗法。
SCLC是最具侵略性的肺癌类型,通常在疾病开始扩散或转移后才被发现。 Best博士说,尽管SCLC患者最初将从化疗中受益,但这些癌症会迅速产生耐药性,平均患者生存期仅为数月。 “ 细胞不是唯一的抗癌免疫细胞,NK细胞也可以攻击肿瘤细胞。因此,我们决定研究哪种免疫疗法对SCLC患者最有希望。”
该团队首先研究了患者SCLC样品中的抗癌免疫标志物。“分析表明,患者体内肿瘤内NK和T细胞相对含量的差异很大。肿瘤中这些细胞的存在表明正在进行抗癌反应。”
为了了解NK或T细胞是否能减缓SCLC的扩散,研究小组研究了缺乏NK或T细胞的疾病的实验模型。 “我们发现NK细胞的缺失使SCLC肿瘤扩散得更多,而T细胞的缺失并没有影响疾病的扩散。这表明NK细胞而非T细胞对限制SCLC的转移很重要。如果我们通过添加细胞因子IL-15激活NK细胞,它们在限制SCLC扩散方面的能力甚至会更好。 激活T细胞和NK细胞进一步减少了SCLC的扩散,表明这两种细胞可以协同工作。”
“我们的研究表明,利用NK细胞的抗肿瘤能力的免疫疗法可能对SCLC更有效。我们认为基于NK细胞的免疫疗法可能是化疗的有效补充,可以减缓疾病的传播并延长SCLC患者的生存期。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


