帕金森症研究进展一览
来源:本站原创 2020-10-24 00:35
本期为大家带来的是帕金森领域的最新研究进展,希望读者朋友们能够喜欢。
2020年10月24日 讯 /生物谷BIOON/ --本期为大家带来的是帕金森领域的最新研究进展,希望读者朋友们能够喜欢。
1. PNAS:打破传统认知!脂质或在帕金森疾病疾病发生过程中扮演关键角色!
DOI:10.1073/pnas.2003021117

近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自麦克林医院等机构的科学家们通过研究发现,一类关键脑细胞的脂质改变或在炎症和帕金森疾病发生过程中扮演着关键角色,相关研究结果有望帮助开发治疗帕金森疾病的新型疗法。
研究者Oeystein R. Brekk指出,这项研究中我们揭示了帕金森疾病中不同类型脑细胞之间脂质的协同使用、储存和运输的重要性,同时我们还阐明了平衡细胞脂质,尤其是中性脂质的分子机制,目前科学家们在理解神经变性疾病中脂质所扮演的关键角色方面还存在很多不足。然而目前研究人员非常清楚,诸如细胞中脂质的使用以及其变化对其它器官所产生的影响,比如很多人都知道,脂质在心血管疾病发病风险增加上扮演的关键作用,与心血管疾病模型一样,研究者基于对帕金森疾病和脂质诱导的帕金森疾病动物模型进行研究也揭示了大脑中脂质依赖性的病理性过程,这就意味着研究者能清楚观察到脂质功能的异常及机体神经性炎症水平的增加。
这项研究中,研究人员在多巴胺能神经元和其它附近的大脑胶质细胞(比如帕金森疾病患者大脑中的小胶质细胞和星形胶质细胞)中观察到了并发性的脂质改变,尤其是小胶质细胞和星形胶质细胞能表现出胞内纸质储存的异常模式,其与多巴胺能神经元中脂质的明显积累直接相关,多巴胺能神经元是疾病进程中最容易受到影响的脑细胞。研究者表示,总体的脂质甘油三酯含量与帕金森疾病患者大脑组织中脂质诱导的炎症压力标志物的水平存在统计学相关性,此外,在一个模拟帕金森疾病的实验动物模型中,研究者还观察到了一种非常相似的脑细胞和病理学图像,这与葡糖脑苷脂酶基因的酶类功能缺失直接相关,这或许会导致糖脂的积累。
研究者指出,在很大程度上能控制大脑中巨噬细胞和免疫细胞功能的小胶质细胞在帕金森疾病进展过程中或会负载更多脂质,而在正常情况下支持脂质维持的星形胶质细胞则会失去部分脂质,与此同时,与周围星形胶质细胞相比,神经元会以一种逆线性的方式来积累脂质,本文研究表明,这或许与一种名为GPNMB的分子之间存在统计学上的显著关联性,这种压力免疫反应分子与星形胶质细胞有关,而星形胶质细胞通常会抑制某些炎症信号,这些炎症信号分子与大脑中黑质区域的脂质积累和总的甘油三酯水平直接相关。
研究者Ole Isacson说道,值得注意的是,我们能在帕金森疾病和健康老龄化个体中模拟这些研究发现,而且易感大脑区域中小胶质细胞和星形胶质细胞之间的相互作用(或能阻断细胞溶酶体中的脂质分解通路)或许是人群患帕金森疾病的强烈风险因子。本文研究结果支持了科学家们关于帕金森疾病发生和进展过程中脂质炎症的相关假说,其或能帮助研究人员通过揭示帕金森疾病的病理学表现来开发新型靶向性疗法,而这或许会在一定程度上摆脱局限于神经元和蛋白质积累的传统认知。
下一步,研究人员还将继续深入研究阐明大脑中脂质细胞间的相互作用是如何随着时间推移而不断具有适应性且出现病理学表现的,同时他们还揭示了这种细胞机制是如何诱发帕金森疾病和路易体痴呆症的。
2. Brain:科学家揭示机体炎症和帕金森疾病发生的分子关联
DOI:10.1093/brain/awaa246
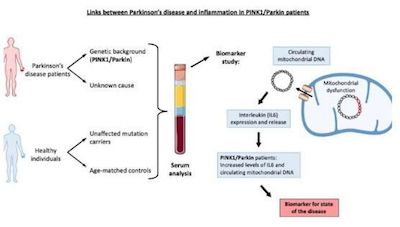
近日,一项刊登在国际杂志Brain上的研究报告中,来自卢森堡大学等机构的科学家们通过研究揭示了炎症和帕金森疾病患者机体特殊遗传突变之间的关联,文章中,研究人员发现了两种生物标志物或能用来评估帕金森疾病的状态和进展状况,相关研究结果表明,利用抗炎性药物来靶向作用机体免疫系统或能潜在影响疾病的过程(至少一部分患者)。
大约15%的帕金森疾病病例都与已知的遗传背景相关,其中Parkin和PINK1基因的突变是最常见的原因,因此,揭示被基因突变所改变的细胞机制或许对于开发新型治疗性手段非常重要;这项研究中,研究人员对两项独立研究中的245名参与者的血清进行了分析,结果发现,携带Parkin或PINK1基因突变的患者机体中循环的线粒体DNA(mtDNA)和白介素6(IL-6)的水平会增加。
研究者指出,Parkin或PINK1蛋白的缺失或会导致线粒体自噬功能受损,线粒体水平的异常则会诱发线粒体DNA的释放,从而诱发炎症并增加患者机体血液中IL-6的水平,当抵达大脑后,IL-6被认为在神经变性疾病发生过程中扮演着非常关键的角色,本文研究结果表明,利用抗炎性药物来治疗或有望减缓帕金森疾病患者的疾病进程。
通过对一个染色体(杂合子)或两个染色体上携带Parkin或PINK1基因突变的患者之间差异进行研究,研究者发现,检测患者血液中系统性炎症的水平或能作为指示这些帕金森疾病遗传形式的特殊生物标志物,相比杂合子患者而言,两个染色体上均携带突变的患者机体中IL-6的水平会更高,但与健康对照人群相比,杂合子患者机体中IL-6的水平也显著升高了,这或许就表明,杂合子突变或许会组成早期帕金森疾病发生的强烈风险因子,即使在这些杂合子携带者疾病发生之前,研究人员就能通过监测其机体血清中IL-6的水平在早期阶段对疾病进行检测,类似地,循环腺体DNA的水平或能作为指示杂合子Parkin/PINK1突变携带者疾病进展的一种有效的标志物。
最后研究者Grünewald表示,本文研究有着潜在的临床应用价值和意义,通过检测患者机体血清中存在的生物标志物或能帮助指示其疾病的进展状态,同时本文研究结果还有望帮助研究人员开发靶向作用Parkin/PINK1相关的帕金森疾病患者先天性免疫反应的新型疗法。
3. Nat Commun:微型大脑"镊"有助于治疗帕金森症
DOI: 10.1038/s41467-020-18689-x
由牛津帕金森病中心的Nora Bengoa-Vergniory博士领导的一项合作研究表明,称为“分子镊子”的化合物可能成为帕金森氏症的有希望的疾病改良疗法。
一组研究人员表明,被称为分子“镊子”的微小化合物可能成为减缓帕金森氏症的有前途的疗法。这种新型药物通过拉开帕金森氏症期间大脑中形成的有毒蛋白质团块而起作用。
以前,该疗法已显示出有潜力靶向在神经退行性疾病(如阿尔茨海默氏病)中形成的有毒蛋白质团块。因此,研究团队调查了一种特定的分子镊子CLR01是否能够减少帕金森氏细胞和小鼠模型中蛋白质团块的形成。
研究表明,CLR01能够减少帕金森蛋白α-突触核蛋白形成的簇,并防止干细胞制成的人类神经元死亡。
研究人员在帕金森氏症的小鼠模型中测试了CLR01,该模型可刺激蛋白质簇的形成并模仿患有这种疾病的人所经历的运动症状,包括震颤和运动缓慢。随着小鼠的衰老,CLR01治疗减少了运动问题的出现和大脑中有毒蛋白质簇的形成。重要的是,研究小组表明,在帕金森氏症进展较快的大龄动物中,CLR01治疗效果较差。
这项工作表明,在帕金森氏症早期使用保护性疗法对于有效治疗至关重要。这些综合结果突出表明,CLR01代表了治疗帕金森氏症的候选人,并强调了在这一领域需要进一步研究的必要性。
首席研究员Nora Bengoa-Vergniory博士说:“为这些治疗剂确定合适的治疗窗口的未来投资对于这些和其他治疗策略的成功至关重要。”
相关结果发表在最近的《Nature Communications》杂志上。
4. Move Disorders:帕金森患者因COVID19死亡风险更高
DOI: 10.1002/mds.28325
一项针对约80,000名患者的最新研究表明,帕金森病患者死于COVID-19的风险比没有神经退行性疾病的人高30%。

爱荷华大学卫生保健大学的研究人员根据TriNetX COVID-19研究网络中的患者数据进行的新分析表明,帕金森氏病是死于COVID-19的独立危险因素。
由神经病学家Nandakumar Narayanan领导的研究小组于7月15日收集了相关COVID-19患者队列,并在8周后分析了其死亡率数据。他们发现未患帕金森症的COVID19患者死亡率为5.5%(78,355名中的4,290名),而患有帕金森症的COVID19患者死亡率则上升到了21.3%(694名中的148名)。
但是,帕金森症患者通常比对照患者年龄更大,男性比例更高。所有这些因素也增加了COVID-19的死亡风险。
因此,研究者们使用了两种方法来解决这些差异:以年龄,性别和种族为协变量的逻辑回归,将每名帕金森症患者与五名年龄,性别和同种族的非帕金森症患者进行匹配,并执行条件逻辑回归。在这两种情况下,研究人员均发现PD患者死于COVID-19的风险高30%。研究结果发表在《Moving Disorder》杂志上。
神经病学副教授Narayanan说:“我们意识到这项研究的局限性;它是来自单个数据库的回顾性数据,但我们有信心这些数据表明帕金森氏病是COVID-19中死亡的独立危险因素。我们相信这种观察将对治疗帕金森氏病患者的临床医生以及公共卫生负责人提供指导。”
研究人员说,这些发现还有助于为帕金森症患者及其医生提供信息,这些患者预防COVID-19感染的重要性日益增加。
5. Neurology:咖啡有助于预防帕金森
DOI: https://doi.org/10.1212/WNL.0000000000010863
根据2020年9月30日发表在《Neurology》杂志上的一项新研究,即使对于携带帕金森氏病相关的基因突变的人,喝咖啡也可能会降低患此病的风险。

波士顿马萨诸塞州总医院医学博士,美国科学院院士,研究作者Grace Crotty说:“这些结果有助于未来开展相关研究,探索与咖啡因有关的疗法,以减少携带相关基因突变的人患帕金森氏症的机会。”此外,血液中的咖啡因水平也有可能被用作生物标志物,以帮助鉴定患病风险。
较早的研究表明,在没有遗传风险的人中,摄入咖啡可以预防帕金森病的发展。这项研究则着眼于具有遗传突变的人,这种突变会增加帕金森氏症的风险。该突变位于富含亮氨酸的LRRK2激酶的基因中,存在异常基因突变并不意味着人们一定会患上这种疾病,因此研究人员希望找出影响人们是否会患上这种疾病的其他遗传或环境因素。
该研究将188名患有帕金森病的人与180名没有帕金森氏症的人进行了比较。两组都包括存在LRRK2基因突变的人和没有LRRK2基因突变的人。研究人员研究了血液中咖啡因的含量,以及咖啡因在体内代谢后产生的其他化学物质的含量,以及各组之间的差异。
在携带LRRK2基因突变的人中,患有帕金森氏症的人血液中咖啡因的浓度比没有帕金森氏症的人低76%。患有帕金森氏症且具有正常基因拷贝的人的血液中咖啡因的浓度比没有帕金森氏症的非携带者低31%。
患有帕金森氏症的基因突变携带者的饮食中咖啡因的摄入量也较低。无论是否患有基因突变,患有帕金森氏症的基因携带者每天所消耗的咖啡因比没有帕金森氏症的人少41%。
“我们还不知道那些容易患帕金森氏症的人是否倾向于不喝咖啡,或者某些突变携带者是否喝了很多咖啡并从中受益?”
6. Cell Stem Cell:移植人干细胞产生的多巴胺能神经元有望治疗帕金森病
doi:10.1016/j.stem.2020.08.014.
在遭受创伤、中风或帕金森病等退行性疾病的损伤后,成熟的大脑在自我修复方面表现得非常糟糕。具有无限适应性的干细胞为更好的神经修复提供了希望。但是,大脑精确调整的复杂性阻碍了临床治疗的开发。
在一项旨在克服这些障碍的新研究中,来自美国威斯康星大学麦迪逊分校、中国科学院脑科学与智能技术卓越创新中心、中国科学院大学、上海脑科学与类脑研究中心和杜克-新加坡国立大学医学院的研究人员在帕金森病的小鼠模型中展示了一种用于概念验证的干细胞疗法。他们发现,由人胚胎干细胞(ESC)产生的神经元可以很好地整合到大脑的正确区域,与内源性的神经元建立连接,并恢复这些小鼠的运动功能。相关研究结果于2020年9月22日在线发表在Cell Stem Cell期刊上,论文标题为“Human Stem Cell-Derived Neurons Repair Circuits and Restore Neural Function”。
关键在于身份。通过仔细追踪移植的干细胞的命运,这些作者发现这些细胞的身份---在帕金森病中指的是产多巴胺神经元(即产生多巴胺的神经元,也称为多巴胺能神经元)---决定了它们产生的连接和功能。
随着越来越多的方法利用干细胞产生几十种独特的神经元,这项研究提示着神经干细胞治疗是一个现实的目标。然而,要将小鼠的研究结果转移到人类,还需要开展更多的研究。
威斯康星大学麦迪逊分校神经科学家Su-Chun Zhang说,“我们的大脑由特定位置的非常专业的神经细胞以如此精确的方式连接在一起,因此我们可以从事所有复杂的行为。这一切都取决于由特定细胞类型连接在一起而形成的神经回路。神经损伤通常会影响特定的大脑区域或特定的细胞类型,从而破坏神经回路。为了治疗这些疾病,我们必须恢复这些神经回路。”
为了修复帕金森病小鼠模型中的这些神经回路,这些作者首先诱导人ESC分化成产多巴胺神经元,这是因为产多巴胺神经元在帕金森病中死亡了。他们将这些新产生的神经元移植到这些小鼠的中脑,这是受帕金森病退化影响最大的大脑区域。
几个月后,在这些新产生的神经元有时间整合到大脑中后,这些小鼠的运动技能有所改善。通过仔细观察,Zhang及其研究团队能够观察到,这些移植的神经元延伸了很长距离,与大脑的运动控制区域连接在一起。它们还与大脑的调节区域建立了连接,这些区域会输入新的神经元,可阻止它们受到过度刺激。
这两组由移植的神经元输入和输出的连接,都类似于内源性神经元建立的神经回路。只有产多巴胺神经元才真正如此。利用产生神经递质谷氨酸的不参与帕金森病产生的神经元开展类似实验,结果表明移植这些产生谷氨酸的神经元不会修复这些小鼠的运动回路,这揭示了神经元身份对修复损伤的重要性。
为了最终确认这些移植的产多巴胺神经元已经修复了帕金森病中受损的神经回路,这些研究人员在人胚胎干细胞中插入了基因开启和关闭开关。当这些细胞在饮食中暴露于专门的设计药物或通过注射药物时,这些开启和关闭开关会将这些细胞的活性调高或调低。
当这些干细胞被关闭时,这些小鼠的运动改善消失了,这表明这些干细胞对恢复帕金森病中受损的大脑至关重要。这项新的研究还表明,这种基因开关技术可用于微调移植细胞的活性,以优化治疗。
Zhang的研究团队和其他研究人员多年来一直在开发将干细胞转化为大脑内多种不同类型神经元的方法。每种神经系统疾病或损伤都需要自己专门的神经细胞来治疗,但治疗方案可能大致相似。Zhang说,“我们用帕金森病作为模型,但对于许多不同的神经系统疾病来说,原理是一样的。”
这项研究对Zhang来说具有个人意义。作为一名医生和科学家,他经常会收到一些家庭的来信,他们迫切希望得到治疗神经系统疾病或脑外伤的帮助。这也是他能感同身受的经历。6年前,Zhang在一次自行车事故中,颈部骨折。当他在医院醒来时,他半身瘫痪,他首先想到的是干细胞---他已经研究了多年---如何可能协助他康复。
如今,经过多年的物理治疗后,Zhang仍然相信正确的干细胞治疗方法在未来可能帮助像他这样的人和他听到的家庭。
为此,Zhang团队目前正在灵长类动物身上测试类似的治疗方法,这是迈向人体临床试验的一步。他说,“希望是有的,但我们需要一步一步来。”
7. Movement Disorder:新冠疫情影响帕金森症的治疗
DOI: 10.1002/mds.28293
由伦敦女王玛丽大学领导的一项全球卫生专业人员调查显示,在COVID-19大流行期间,亚洲,非洲以及拉丁美洲和南美大部分地区的帕金森氏病患者在获取药物方面遇到了困难,可能导致症状控制恶化。

运动障碍协会于2020年6月在COVID19大流行高峰期进行的电子邮件调查收到了来自76个国家/地区的346位成员的回复。答复表明,低收入国家中88.9%的人认为获得帕金森病药物受到COVID-19的影响,而高收入国家中这一比例为22.8%。低收入国家中所有接受调查的卫生专业人员均表示,这将导致残疾增加。与较富裕的国家相比,资源匮乏的国家似乎受到的影响最大。
通讯作者,玛丽皇后大学沃尔夫森研究所预防神经病学部门的Alastair Noyce博士说:“这项研究表明,来自东亚,欧洲和北美高收入国家的患者受到的影响较小,但中低收入国家的患者受到的影响较小难以获得药物治疗,继而导致发病率恶化。结果进一步证明了按地区和财富划分的帕金森氏病日常护理不平等,而COVID-19加剧了这种情况。”
8. JNNP: 新研究可提高帕金森症的预测准确性
DOI: 10.1136/jnnp-2020-323646
伦敦女王玛丽大学领导的一项研究表明,遗传标记可改善帕金森病的预测准确性。
帕金森病是全球第二大最常见的神经退行性疾病。在被诊断出该疾病时,已经造成了永久性的不可逆转的损害。识别有风险的人或及早发现疾病是预防或开发有效的帕金森氏病治疗方法的最大希望。
研究人员利用来自2000多名被诊断为帕金森氏症的患者的数据,并与英国生物库中的100万名对照进行比较,研究人员首先调查了某些风险因素与帕金森氏症的相关性。具有该疾病的家族病史,不吸烟,饮酒少,抑郁,白天嗜睡,癫痫,初潮更早以及痴呆症家族史等因素与帕金森氏症的个体关联较小。

遗传风险因素也有助于帕金森氏症的出现,并且通过将遗传因素与“多基因风险评分”和上述因素相结合,预测帕金森氏症的能力会有所改善。研究人员继续表明,环境和遗传风险因素之间的相互作用可以解释更多的遗漏风险。
玛丽皇后医院沃尔夫森预防医学研究所的通讯作者Alastair Noyce博士说:“这些结果提供了进一步的证据,表明我们可以鉴定出帕金森氏病风险较高的人群,他们将是神经保护药物试验或其他预防策略的理想候选人群体。研究在考虑预防帕金森氏病以及谁是预防的最佳人群方面又向前迈进了一步。”
9. Sci Trans Med: 新研究有助于治疗帕金森
在最近一项研究中,科学家们已经阐明了某些帕金森症背后的遗传学原因,并确定了潜在的药物治疗方法。卢森堡大学卢森堡系统生物医学中心(LCSB)的RejkoKrüger教授领导的跨学科研究团队在实验室中对基于患者的细胞培养进行了实验。相关结果发表在《Science Translational Medicine》杂志上。
一种称为DJ-1的蛋白质在保持神经细胞功能中起着至关重要的作用。如果人体无法产生大量的DJ-1,重要的神经细胞就会死亡。结果是神经退行性疾病如帕金森氏症的发作。如果重要的遗传图谱或它们编码的生产过程存在缺陷,则像DJ-1这样的重要蛋白质的生产可能会被永久破坏或停止。
RejkoKrüger教授首次确定了DJ-1合成过程中发生的错误,这种错误在某种形式的帕金森氏病的发展中被称为“拼接”。 “在患者体内,组装蛋白质DJ-1的基本工具无法正确对接。” “用科学的术语来说,我们称其为外显子跳跃。由于这种缺陷,蛋白质无法生成。”该研究结果为用药物治疗这种蛋白质合成失灵提供了一个全新的靶点。第一作者Ibrahim Boussaad博士说:“这种见解从根本上改变了我们对疾病原因的看法,并提出了全新的治疗可能性。”
在LCSB上开发的精确生物信息学算法使研究团队能够立即自动搜索可能的药物,并最终发现了具有活性的化合物苯基丁酸和RECTAS。两种活性物质组合使用,可使细胞重新激活DJ-1的合成过程。 RejkoKrüger教授解释说:“只有结合医学实践到实验室研究再到计算机科学,我们才能了解原因并同时确定可能用于治疗的活性物质。”
10. Stem Cell Rep:科学家有望利用一种细胞循环工具来治疗帕金森疾病
doi:10.1016/j.stemcr.2020.07.013
近日,一篇发表在国际杂志Stem Cell Reports上的研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究深入分析了细胞中循环线粒体的分子机器,旨在阐明如何提升这种产生能量结构(线粒体)的产量,研究者表示,线粒体出现问题是帕金森疾病发生的一个关键方面,研究人员重点对神经元进行了研究,神经元细胞能够释放一种名为多巴胺的化学信使分子,这种所谓的多巴胺能神经元(dopamine neurons)与机体参与奖惩和动力的加工行为密切相关,但其似乎还参与到了机体的运动过程中去。
震颤、肌肉僵硬和其它运动问题在帕金森疾病中非常常见,如今美国大约有100万名帕金森疾病患者。为了研究神经元与帕金森疾病发生之间的关联,研究人员最近开发出了多种工具,其中就包括一种新型的荧光探针,其能轻松识别新产生的以及老化的线粒体;与其它细胞一样,多巴胺能神经元能够维持一种质量控制过程,帮助降解老化、磨损的线粒体并制造新的线粒体,长期以来科学家们一直知道,功能失常的线粒体主要存在于多巴胺能神经元中,此外研究者还发现,名为PARKIN的基因还与遗传性的帕金森疾病发生相关,这类帕金森疾病一般在个体40岁甚至更年轻时发生。
为了更好地理解基因的行为机制,研究人员分析了缺少PARKIN基因的人类多巴胺能神经元,以及衍生自胚胎干细胞和帕金森疾病患者体内的多巴胺能神经元,这些神经元均失去了制造新型、功能完整线粒体的能力;研究者注意到,线粒体功能失调且失去PARKIN基因的神经元中PARIS基因会处于过度激活状态,该基因与线粒体的调节直接相关,当研究者对神经元进行遗传工程化修饰移除PARIS和PARKIN基因后,这些神经元依然会持续制造新的线粒体,而且会持续移除老化的线粒体(尽管程度较轻)。
携带过度激活状态PARIS基因的细胞会失去制造新型线粒体的能力,而PARIS活性较低的神经元细胞则会很轻松地制造线粒体,同时还会对老化线粒体的移除产生一些效应,这似乎就表明,新线粒体的产生对于多巴胺能神经元的维护和生存至关重要。最后研究者Dawson表示,利用特殊药物靶向作用PARIS来降低其表达蛋白的水平或有望作为一种新方法来治疗帕金森疾病患者。(生物谷Bioon.com)
1. PNAS:打破传统认知!脂质或在帕金森疾病疾病发生过程中扮演关键角色!
DOI:10.1073/pnas.2003021117

近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自麦克林医院等机构的科学家们通过研究发现,一类关键脑细胞的脂质改变或在炎症和帕金森疾病发生过程中扮演着关键角色,相关研究结果有望帮助开发治疗帕金森疾病的新型疗法。
研究者Oeystein R. Brekk指出,这项研究中我们揭示了帕金森疾病中不同类型脑细胞之间脂质的协同使用、储存和运输的重要性,同时我们还阐明了平衡细胞脂质,尤其是中性脂质的分子机制,目前科学家们在理解神经变性疾病中脂质所扮演的关键角色方面还存在很多不足。然而目前研究人员非常清楚,诸如细胞中脂质的使用以及其变化对其它器官所产生的影响,比如很多人都知道,脂质在心血管疾病发病风险增加上扮演的关键作用,与心血管疾病模型一样,研究者基于对帕金森疾病和脂质诱导的帕金森疾病动物模型进行研究也揭示了大脑中脂质依赖性的病理性过程,这就意味着研究者能清楚观察到脂质功能的异常及机体神经性炎症水平的增加。
这项研究中,研究人员在多巴胺能神经元和其它附近的大脑胶质细胞(比如帕金森疾病患者大脑中的小胶质细胞和星形胶质细胞)中观察到了并发性的脂质改变,尤其是小胶质细胞和星形胶质细胞能表现出胞内纸质储存的异常模式,其与多巴胺能神经元中脂质的明显积累直接相关,多巴胺能神经元是疾病进程中最容易受到影响的脑细胞。研究者表示,总体的脂质甘油三酯含量与帕金森疾病患者大脑组织中脂质诱导的炎症压力标志物的水平存在统计学相关性,此外,在一个模拟帕金森疾病的实验动物模型中,研究者还观察到了一种非常相似的脑细胞和病理学图像,这与葡糖脑苷脂酶基因的酶类功能缺失直接相关,这或许会导致糖脂的积累。
研究者指出,在很大程度上能控制大脑中巨噬细胞和免疫细胞功能的小胶质细胞在帕金森疾病进展过程中或会负载更多脂质,而在正常情况下支持脂质维持的星形胶质细胞则会失去部分脂质,与此同时,与周围星形胶质细胞相比,神经元会以一种逆线性的方式来积累脂质,本文研究表明,这或许与一种名为GPNMB的分子之间存在统计学上的显著关联性,这种压力免疫反应分子与星形胶质细胞有关,而星形胶质细胞通常会抑制某些炎症信号,这些炎症信号分子与大脑中黑质区域的脂质积累和总的甘油三酯水平直接相关。
研究者Ole Isacson说道,值得注意的是,我们能在帕金森疾病和健康老龄化个体中模拟这些研究发现,而且易感大脑区域中小胶质细胞和星形胶质细胞之间的相互作用(或能阻断细胞溶酶体中的脂质分解通路)或许是人群患帕金森疾病的强烈风险因子。本文研究结果支持了科学家们关于帕金森疾病发生和进展过程中脂质炎症的相关假说,其或能帮助研究人员通过揭示帕金森疾病的病理学表现来开发新型靶向性疗法,而这或许会在一定程度上摆脱局限于神经元和蛋白质积累的传统认知。
下一步,研究人员还将继续深入研究阐明大脑中脂质细胞间的相互作用是如何随着时间推移而不断具有适应性且出现病理学表现的,同时他们还揭示了这种细胞机制是如何诱发帕金森疾病和路易体痴呆症的。
2. Brain:科学家揭示机体炎症和帕金森疾病发生的分子关联
DOI:10.1093/brain/awaa246

近日,一项刊登在国际杂志Brain上的研究报告中,来自卢森堡大学等机构的科学家们通过研究揭示了炎症和帕金森疾病患者机体特殊遗传突变之间的关联,文章中,研究人员发现了两种生物标志物或能用来评估帕金森疾病的状态和进展状况,相关研究结果表明,利用抗炎性药物来靶向作用机体免疫系统或能潜在影响疾病的过程(至少一部分患者)。
大约15%的帕金森疾病病例都与已知的遗传背景相关,其中Parkin和PINK1基因的突变是最常见的原因,因此,揭示被基因突变所改变的细胞机制或许对于开发新型治疗性手段非常重要;这项研究中,研究人员对两项独立研究中的245名参与者的血清进行了分析,结果发现,携带Parkin或PINK1基因突变的患者机体中循环的线粒体DNA(mtDNA)和白介素6(IL-6)的水平会增加。
研究者指出,Parkin或PINK1蛋白的缺失或会导致线粒体自噬功能受损,线粒体水平的异常则会诱发线粒体DNA的释放,从而诱发炎症并增加患者机体血液中IL-6的水平,当抵达大脑后,IL-6被认为在神经变性疾病发生过程中扮演着非常关键的角色,本文研究结果表明,利用抗炎性药物来治疗或有望减缓帕金森疾病患者的疾病进程。
通过对一个染色体(杂合子)或两个染色体上携带Parkin或PINK1基因突变的患者之间差异进行研究,研究者发现,检测患者血液中系统性炎症的水平或能作为指示这些帕金森疾病遗传形式的特殊生物标志物,相比杂合子患者而言,两个染色体上均携带突变的患者机体中IL-6的水平会更高,但与健康对照人群相比,杂合子患者机体中IL-6的水平也显著升高了,这或许就表明,杂合子突变或许会组成早期帕金森疾病发生的强烈风险因子,即使在这些杂合子携带者疾病发生之前,研究人员就能通过监测其机体血清中IL-6的水平在早期阶段对疾病进行检测,类似地,循环腺体DNA的水平或能作为指示杂合子Parkin/PINK1突变携带者疾病进展的一种有效的标志物。
最后研究者Grünewald表示,本文研究有着潜在的临床应用价值和意义,通过检测患者机体血清中存在的生物标志物或能帮助指示其疾病的进展状态,同时本文研究结果还有望帮助研究人员开发靶向作用Parkin/PINK1相关的帕金森疾病患者先天性免疫反应的新型疗法。
3. Nat Commun:微型大脑"镊"有助于治疗帕金森症
DOI: 10.1038/s41467-020-18689-x
由牛津帕金森病中心的Nora Bengoa-Vergniory博士领导的一项合作研究表明,称为“分子镊子”的化合物可能成为帕金森氏症的有希望的疾病改良疗法。

一组研究人员表明,被称为分子“镊子”的微小化合物可能成为减缓帕金森氏症的有前途的疗法。这种新型药物通过拉开帕金森氏症期间大脑中形成的有毒蛋白质团块而起作用。
以前,该疗法已显示出有潜力靶向在神经退行性疾病(如阿尔茨海默氏病)中形成的有毒蛋白质团块。因此,研究团队调查了一种特定的分子镊子CLR01是否能够减少帕金森氏细胞和小鼠模型中蛋白质团块的形成。
研究表明,CLR01能够减少帕金森蛋白α-突触核蛋白形成的簇,并防止干细胞制成的人类神经元死亡。
研究人员在帕金森氏症的小鼠模型中测试了CLR01,该模型可刺激蛋白质簇的形成并模仿患有这种疾病的人所经历的运动症状,包括震颤和运动缓慢。随着小鼠的衰老,CLR01治疗减少了运动问题的出现和大脑中有毒蛋白质簇的形成。重要的是,研究小组表明,在帕金森氏症进展较快的大龄动物中,CLR01治疗效果较差。
这项工作表明,在帕金森氏症早期使用保护性疗法对于有效治疗至关重要。这些综合结果突出表明,CLR01代表了治疗帕金森氏症的候选人,并强调了在这一领域需要进一步研究的必要性。
首席研究员Nora Bengoa-Vergniory博士说:“为这些治疗剂确定合适的治疗窗口的未来投资对于这些和其他治疗策略的成功至关重要。”
相关结果发表在最近的《Nature Communications》杂志上。
4. Move Disorders:帕金森患者因COVID19死亡风险更高
DOI: 10.1002/mds.28325
一项针对约80,000名患者的最新研究表明,帕金森病患者死于COVID-19的风险比没有神经退行性疾病的人高30%。

爱荷华大学卫生保健大学的研究人员根据TriNetX COVID-19研究网络中的患者数据进行的新分析表明,帕金森氏病是死于COVID-19的独立危险因素。
由神经病学家Nandakumar Narayanan领导的研究小组于7月15日收集了相关COVID-19患者队列,并在8周后分析了其死亡率数据。他们发现未患帕金森症的COVID19患者死亡率为5.5%(78,355名中的4,290名),而患有帕金森症的COVID19患者死亡率则上升到了21.3%(694名中的148名)。
但是,帕金森症患者通常比对照患者年龄更大,男性比例更高。所有这些因素也增加了COVID-19的死亡风险。
因此,研究者们使用了两种方法来解决这些差异:以年龄,性别和种族为协变量的逻辑回归,将每名帕金森症患者与五名年龄,性别和同种族的非帕金森症患者进行匹配,并执行条件逻辑回归。在这两种情况下,研究人员均发现PD患者死于COVID-19的风险高30%。研究结果发表在《Moving Disorder》杂志上。
神经病学副教授Narayanan说:“我们意识到这项研究的局限性;它是来自单个数据库的回顾性数据,但我们有信心这些数据表明帕金森氏病是COVID-19中死亡的独立危险因素。我们相信这种观察将对治疗帕金森氏病患者的临床医生以及公共卫生负责人提供指导。”
研究人员说,这些发现还有助于为帕金森症患者及其医生提供信息,这些患者预防COVID-19感染的重要性日益增加。
5. Neurology:咖啡有助于预防帕金森
DOI: https://doi.org/10.1212/WNL.0000000000010863
根据2020年9月30日发表在《Neurology》杂志上的一项新研究,即使对于携带帕金森氏病相关的基因突变的人,喝咖啡也可能会降低患此病的风险。

波士顿马萨诸塞州总医院医学博士,美国科学院院士,研究作者Grace Crotty说:“这些结果有助于未来开展相关研究,探索与咖啡因有关的疗法,以减少携带相关基因突变的人患帕金森氏症的机会。”此外,血液中的咖啡因水平也有可能被用作生物标志物,以帮助鉴定患病风险。
较早的研究表明,在没有遗传风险的人中,摄入咖啡可以预防帕金森病的发展。这项研究则着眼于具有遗传突变的人,这种突变会增加帕金森氏症的风险。该突变位于富含亮氨酸的LRRK2激酶的基因中,存在异常基因突变并不意味着人们一定会患上这种疾病,因此研究人员希望找出影响人们是否会患上这种疾病的其他遗传或环境因素。
该研究将188名患有帕金森病的人与180名没有帕金森氏症的人进行了比较。两组都包括存在LRRK2基因突变的人和没有LRRK2基因突变的人。研究人员研究了血液中咖啡因的含量,以及咖啡因在体内代谢后产生的其他化学物质的含量,以及各组之间的差异。
在携带LRRK2基因突变的人中,患有帕金森氏症的人血液中咖啡因的浓度比没有帕金森氏症的人低76%。患有帕金森氏症且具有正常基因拷贝的人的血液中咖啡因的浓度比没有帕金森氏症的非携带者低31%。
患有帕金森氏症的基因突变携带者的饮食中咖啡因的摄入量也较低。无论是否患有基因突变,患有帕金森氏症的基因携带者每天所消耗的咖啡因比没有帕金森氏症的人少41%。
“我们还不知道那些容易患帕金森氏症的人是否倾向于不喝咖啡,或者某些突变携带者是否喝了很多咖啡并从中受益?”
6. Cell Stem Cell:移植人干细胞产生的多巴胺能神经元有望治疗帕金森病
doi:10.1016/j.stem.2020.08.014.
在遭受创伤、中风或帕金森病等退行性疾病的损伤后,成熟的大脑在自我修复方面表现得非常糟糕。具有无限适应性的干细胞为更好的神经修复提供了希望。但是,大脑精确调整的复杂性阻碍了临床治疗的开发。
在一项旨在克服这些障碍的新研究中,来自美国威斯康星大学麦迪逊分校、中国科学院脑科学与智能技术卓越创新中心、中国科学院大学、上海脑科学与类脑研究中心和杜克-新加坡国立大学医学院的研究人员在帕金森病的小鼠模型中展示了一种用于概念验证的干细胞疗法。他们发现,由人胚胎干细胞(ESC)产生的神经元可以很好地整合到大脑的正确区域,与内源性的神经元建立连接,并恢复这些小鼠的运动功能。相关研究结果于2020年9月22日在线发表在Cell Stem Cell期刊上,论文标题为“Human Stem Cell-Derived Neurons Repair Circuits and Restore Neural Function”。
关键在于身份。通过仔细追踪移植的干细胞的命运,这些作者发现这些细胞的身份---在帕金森病中指的是产多巴胺神经元(即产生多巴胺的神经元,也称为多巴胺能神经元)---决定了它们产生的连接和功能。
随着越来越多的方法利用干细胞产生几十种独特的神经元,这项研究提示着神经干细胞治疗是一个现实的目标。然而,要将小鼠的研究结果转移到人类,还需要开展更多的研究。
威斯康星大学麦迪逊分校神经科学家Su-Chun Zhang说,“我们的大脑由特定位置的非常专业的神经细胞以如此精确的方式连接在一起,因此我们可以从事所有复杂的行为。这一切都取决于由特定细胞类型连接在一起而形成的神经回路。神经损伤通常会影响特定的大脑区域或特定的细胞类型,从而破坏神经回路。为了治疗这些疾病,我们必须恢复这些神经回路。”
为了修复帕金森病小鼠模型中的这些神经回路,这些作者首先诱导人ESC分化成产多巴胺神经元,这是因为产多巴胺神经元在帕金森病中死亡了。他们将这些新产生的神经元移植到这些小鼠的中脑,这是受帕金森病退化影响最大的大脑区域。
几个月后,在这些新产生的神经元有时间整合到大脑中后,这些小鼠的运动技能有所改善。通过仔细观察,Zhang及其研究团队能够观察到,这些移植的神经元延伸了很长距离,与大脑的运动控制区域连接在一起。它们还与大脑的调节区域建立了连接,这些区域会输入新的神经元,可阻止它们受到过度刺激。
这两组由移植的神经元输入和输出的连接,都类似于内源性神经元建立的神经回路。只有产多巴胺神经元才真正如此。利用产生神经递质谷氨酸的不参与帕金森病产生的神经元开展类似实验,结果表明移植这些产生谷氨酸的神经元不会修复这些小鼠的运动回路,这揭示了神经元身份对修复损伤的重要性。
为了最终确认这些移植的产多巴胺神经元已经修复了帕金森病中受损的神经回路,这些研究人员在人胚胎干细胞中插入了基因开启和关闭开关。当这些细胞在饮食中暴露于专门的设计药物或通过注射药物时,这些开启和关闭开关会将这些细胞的活性调高或调低。
当这些干细胞被关闭时,这些小鼠的运动改善消失了,这表明这些干细胞对恢复帕金森病中受损的大脑至关重要。这项新的研究还表明,这种基因开关技术可用于微调移植细胞的活性,以优化治疗。
Zhang的研究团队和其他研究人员多年来一直在开发将干细胞转化为大脑内多种不同类型神经元的方法。每种神经系统疾病或损伤都需要自己专门的神经细胞来治疗,但治疗方案可能大致相似。Zhang说,“我们用帕金森病作为模型,但对于许多不同的神经系统疾病来说,原理是一样的。”
这项研究对Zhang来说具有个人意义。作为一名医生和科学家,他经常会收到一些家庭的来信,他们迫切希望得到治疗神经系统疾病或脑外伤的帮助。这也是他能感同身受的经历。6年前,Zhang在一次自行车事故中,颈部骨折。当他在医院醒来时,他半身瘫痪,他首先想到的是干细胞---他已经研究了多年---如何可能协助他康复。
如今,经过多年的物理治疗后,Zhang仍然相信正确的干细胞治疗方法在未来可能帮助像他这样的人和他听到的家庭。
为此,Zhang团队目前正在灵长类动物身上测试类似的治疗方法,这是迈向人体临床试验的一步。他说,“希望是有的,但我们需要一步一步来。”
7. Movement Disorder:新冠疫情影响帕金森症的治疗
DOI: 10.1002/mds.28293
由伦敦女王玛丽大学领导的一项全球卫生专业人员调查显示,在COVID-19大流行期间,亚洲,非洲以及拉丁美洲和南美大部分地区的帕金森氏病患者在获取药物方面遇到了困难,可能导致症状控制恶化。

运动障碍协会于2020年6月在COVID19大流行高峰期进行的电子邮件调查收到了来自76个国家/地区的346位成员的回复。答复表明,低收入国家中88.9%的人认为获得帕金森病药物受到COVID-19的影响,而高收入国家中这一比例为22.8%。低收入国家中所有接受调查的卫生专业人员均表示,这将导致残疾增加。与较富裕的国家相比,资源匮乏的国家似乎受到的影响最大。
通讯作者,玛丽皇后大学沃尔夫森研究所预防神经病学部门的Alastair Noyce博士说:“这项研究表明,来自东亚,欧洲和北美高收入国家的患者受到的影响较小,但中低收入国家的患者受到的影响较小难以获得药物治疗,继而导致发病率恶化。结果进一步证明了按地区和财富划分的帕金森氏病日常护理不平等,而COVID-19加剧了这种情况。”
8. JNNP: 新研究可提高帕金森症的预测准确性
DOI: 10.1136/jnnp-2020-323646
伦敦女王玛丽大学领导的一项研究表明,遗传标记可改善帕金森病的预测准确性。
帕金森病是全球第二大最常见的神经退行性疾病。在被诊断出该疾病时,已经造成了永久性的不可逆转的损害。识别有风险的人或及早发现疾病是预防或开发有效的帕金森氏病治疗方法的最大希望。
研究人员利用来自2000多名被诊断为帕金森氏症的患者的数据,并与英国生物库中的100万名对照进行比较,研究人员首先调查了某些风险因素与帕金森氏症的相关性。具有该疾病的家族病史,不吸烟,饮酒少,抑郁,白天嗜睡,癫痫,初潮更早以及痴呆症家族史等因素与帕金森氏症的个体关联较小。

遗传风险因素也有助于帕金森氏症的出现,并且通过将遗传因素与“多基因风险评分”和上述因素相结合,预测帕金森氏症的能力会有所改善。研究人员继续表明,环境和遗传风险因素之间的相互作用可以解释更多的遗漏风险。
玛丽皇后医院沃尔夫森预防医学研究所的通讯作者Alastair Noyce博士说:“这些结果提供了进一步的证据,表明我们可以鉴定出帕金森氏病风险较高的人群,他们将是神经保护药物试验或其他预防策略的理想候选人群体。研究在考虑预防帕金森氏病以及谁是预防的最佳人群方面又向前迈进了一步。”
9. Sci Trans Med: 新研究有助于治疗帕金森
在最近一项研究中,科学家们已经阐明了某些帕金森症背后的遗传学原因,并确定了潜在的药物治疗方法。卢森堡大学卢森堡系统生物医学中心(LCSB)的RejkoKrüger教授领导的跨学科研究团队在实验室中对基于患者的细胞培养进行了实验。相关结果发表在《Science Translational Medicine》杂志上。

一种称为DJ-1的蛋白质在保持神经细胞功能中起着至关重要的作用。如果人体无法产生大量的DJ-1,重要的神经细胞就会死亡。结果是神经退行性疾病如帕金森氏症的发作。如果重要的遗传图谱或它们编码的生产过程存在缺陷,则像DJ-1这样的重要蛋白质的生产可能会被永久破坏或停止。
RejkoKrüger教授首次确定了DJ-1合成过程中发生的错误,这种错误在某种形式的帕金森氏病的发展中被称为“拼接”。 “在患者体内,组装蛋白质DJ-1的基本工具无法正确对接。” “用科学的术语来说,我们称其为外显子跳跃。由于这种缺陷,蛋白质无法生成。”该研究结果为用药物治疗这种蛋白质合成失灵提供了一个全新的靶点。第一作者Ibrahim Boussaad博士说:“这种见解从根本上改变了我们对疾病原因的看法,并提出了全新的治疗可能性。”
在LCSB上开发的精确生物信息学算法使研究团队能够立即自动搜索可能的药物,并最终发现了具有活性的化合物苯基丁酸和RECTAS。两种活性物质组合使用,可使细胞重新激活DJ-1的合成过程。 RejkoKrüger教授解释说:“只有结合医学实践到实验室研究再到计算机科学,我们才能了解原因并同时确定可能用于治疗的活性物质。”
10. Stem Cell Rep:科学家有望利用一种细胞循环工具来治疗帕金森疾病
doi:10.1016/j.stemcr.2020.07.013
近日,一篇发表在国际杂志Stem Cell Reports上的研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究深入分析了细胞中循环线粒体的分子机器,旨在阐明如何提升这种产生能量结构(线粒体)的产量,研究者表示,线粒体出现问题是帕金森疾病发生的一个关键方面,研究人员重点对神经元进行了研究,神经元细胞能够释放一种名为多巴胺的化学信使分子,这种所谓的多巴胺能神经元(dopamine neurons)与机体参与奖惩和动力的加工行为密切相关,但其似乎还参与到了机体的运动过程中去。

震颤、肌肉僵硬和其它运动问题在帕金森疾病中非常常见,如今美国大约有100万名帕金森疾病患者。为了研究神经元与帕金森疾病发生之间的关联,研究人员最近开发出了多种工具,其中就包括一种新型的荧光探针,其能轻松识别新产生的以及老化的线粒体;与其它细胞一样,多巴胺能神经元能够维持一种质量控制过程,帮助降解老化、磨损的线粒体并制造新的线粒体,长期以来科学家们一直知道,功能失常的线粒体主要存在于多巴胺能神经元中,此外研究者还发现,名为PARKIN的基因还与遗传性的帕金森疾病发生相关,这类帕金森疾病一般在个体40岁甚至更年轻时发生。
为了更好地理解基因的行为机制,研究人员分析了缺少PARKIN基因的人类多巴胺能神经元,以及衍生自胚胎干细胞和帕金森疾病患者体内的多巴胺能神经元,这些神经元均失去了制造新型、功能完整线粒体的能力;研究者注意到,线粒体功能失调且失去PARKIN基因的神经元中PARIS基因会处于过度激活状态,该基因与线粒体的调节直接相关,当研究者对神经元进行遗传工程化修饰移除PARIS和PARKIN基因后,这些神经元依然会持续制造新的线粒体,而且会持续移除老化的线粒体(尽管程度较轻)。
携带过度激活状态PARIS基因的细胞会失去制造新型线粒体的能力,而PARIS活性较低的神经元细胞则会很轻松地制造线粒体,同时还会对老化线粒体的移除产生一些效应,这似乎就表明,新线粒体的产生对于多巴胺能神经元的维护和生存至关重要。最后研究者Dawson表示,利用特殊药物靶向作用PARIS来降低其表达蛋白的水平或有望作为一种新方法来治疗帕金森疾病患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


