阿斯利康/第一三共重磅ADC疗法在华递交又一临床试验申请
来源:药明康德 2020-10-15 12:31
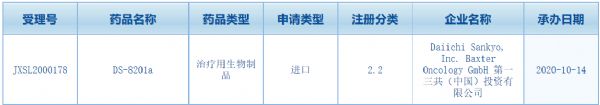
10月14日,中国国家药监局药品审评中心(CDE)网站最新公示,第一三共(Daiichi Sankyo)在中国提交了抗体偶联药物Enhertu(DS-8201)的一项新临床试验申请。这款HER2靶向ADC疗法是阿斯利康(AstraZeneca)和第一三共的重点开发项目,背后合作金额高达69亿美元。今年以来,Enhertu陆续取得多项进展:在202
10月14日,中国国家药监局药品审评中心(CDE)网站最新公示,第一三共(Daiichi Sankyo)在中国提交了抗体偶联药物Enhertu(DS-8201)的一项新临床试验申请。这款HER2靶向ADC疗法是阿斯利康(AstraZeneca)和第一三共的重点开发项目,背后合作金额高达69亿美元。
今年以来,Enhertu陆续取得多项进展:在2020年美国临床肿瘤学会(ASCO)上公布胃癌、结直肠癌、肺癌等多项临床结果;斩获美国FDA的第三项突破性疗法认定,治疗携带HER2突变的转移性非小细胞肺癌(NSCLC)患者;在日本获批新适应症,用于治疗HER2阳性无法切除的晚期或复发胃癌患者。
Enhertu是一款靶向HER2的抗体偶联药物(ADC),利用第一三共特有的ADC技术,将人源HER2抗体曲妥珠单抗通过四肽接头与一种新型拓扑异构酶1抑制剂链接,靶向癌细胞,并将药物递送至细胞内部。相比通常的化疗方式,这类新型药物可以降低化疗药的毒副作用。
一直以来,Enhertu的开发就备受关注。它曾被EvaluatePharma列为2024年10大潜在重磅药之一。2019年3月,阿斯利康斥69亿美元巨资与第一三共达成合作,在全球范围内共同开发和商业推广Enhertu。它还获得了三项美国FDA授予的突破性疗法认定,用于治疗HER2阳性乳腺癌、胃癌和NSCLC患者。
2019年底,Enhertu在美国获得FDA加速批准上市,治疗无法切除或接受过2种以上抗HER2疗法治疗的转移性HER2阳性乳腺癌患者。今年9月,该产品扩展适应症获得日本厚生劳动省(MHLW)批准,用于治疗HER2阳性无法切除的晚期或复发胃癌患者。
在中国,根据CDE官网信息,DS-8201a于2018年11月首次在中国申报临床并获得受理。目前,该产品已在中国递交共计多项临床试验申请,其中3项已获得临床试验默示许可,拟开发适应症包括:
· 人表皮生长因子受体2(HER2)阳性表达的不可切除/转移性乳腺癌;
· 人表皮生长因子受体2(HER2)低表达的不可切除和/或转移性乳腺癌;
· 人表皮生长因子受体2(HER2)低表达、激素受体(HR)阳性的晚期或转移性乳腺癌在内分泌治疗后出现疾病进展者。
根据中国药物临床试验登记与信息公示平台,目前,一项在HER2低表达晚期乳腺癌患者对比新靶向疗法DS-8201a与医生所选治疗的3期、多中心、随机、开放性、活性对照试验正在进行中。
根据公开资料,阿斯利康和第一三共计划展开超过40项临床试验,探索Enhertu在治疗HER2低表达乳腺癌,以及HER2阳性肺癌、胃癌、结直肠癌和不限癌种适应症方面的疗效。此次该产品在中国提交新的临床试验申请,也意味着它将有望在中国开展针对更多适应症的临床试验。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。