针对新冠病毒SARS-CoV-2/COVID-19,Science期刊研究进展一览(第4期)
来源:本站原创 2020-09-30 20:12
2020年9月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭
2020年9月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的 症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Science期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Science:揭示病情较重的COVID-19患者存在三种不同的免疫反应
doi:10.1126/science.abc8511
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现针对SARS-CoV-2感染的三种不同的免疫反应,这可能有助于预测重症COVID-19患者的疾病轨迹,并可能最终为如何最好地治疗他们提供信息。相关研究结果于2020年7月15日在线发表在Science期刊上,论文标题为“Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications”。

论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院系统药理学与转化治疗学系主任E. John Wherry博士说,“对于住院的COVID-19患者,免疫系统的反应方式并不只有一种。有很多异质性,我们将其归纳为我们所说的三种‘免疫型(immunotype)’。我们希望我们可能真地能够根据临床数据预测,或者至少推断出患者具有的不同免疫模式。这将使我们能够开始考虑让患者参加不同类型的临床试验。”
2.Science:新研究指出针对新冠肺炎而言,实现群体免疫的门槛下降了
doi:10.1126/science.abc6810
根据一项新的研究,在比以前估计的感染人数更少的情况下,可以实现对COVID-19的群体免疫(herd immunity)。
在这项新的研究中,来自英国诺丁汉大学和瑞典斯德哥尔摩大学的研究人员设计了一种简单的模型,将人分为反映年龄和社会活动水平的群体。当年龄和社会活动的差异被纳入这种模型时,群体免疫水平从60%降低到43%。43%这个数字应该被解释为一个例子,而不是一个确切的数值,甚至是最好的估计。相关研究结果于2020年6月23日在线发表在Science期刊上,论文标题为“A mathematical model reveals the influence of population heterogeneity on herd immunity to SARS-CoV-2”。
这项研究采用一种新的数学方法来估计人群对诸如当前的COVID-19大流行之类的传染病的群体免疫水平。群体免疫水平的定义是,当所有预防措施(如社会隔离)被取消后,为了使得疾病传播下降和停止,必须产生免疫力的人口比例。就COVID-19而言,人们经常说这一数字约为60%,这一数字是根据为防止大规模疫情爆发而必须接种疫苗(在流行病发生前)的那部分人口得出的。
论文共同作者、诺丁汉大学的Frank Ball教授解释道,“通过采用这种新的数学方法来估计实现群体免疫的人群比例,我们发现这有可能被降低到43%,而且这种降低主要是由于活动水平而不是年龄结构引起的。因此,社会活跃度越高的个体比社会活跃度较低的个体更容易被感染,而且如果他们被感染,他们也更容易感染人。结果就是,相比于通过接种疫苗获得的免疫水平,当免疫力由疾病传播引起时,群体免疫水平要低一些。我们的研究结果对当前COVID-19大流行和解除封锁有潜在的影响,并表明个体差异(如活动水平)是指导政策的模型中应包含的重要特征。”
3.Science:我国科学家发现人中和抗体结合SARS-CoV-2刺突蛋白的N端结构域
doi:10.1126/science.abc6952
三聚体刺突蛋白(S蛋白)装饰着冠状病毒的表面,在病毒进入过程中起着关键作用。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD,1-1208个氨基酸)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。RBD负责与ACE2结合,而NTD的功能尚不十分清楚。在一些冠状病毒中,NTD可能在初始附着时识别特定的糖基团,并可能在S蛋白从融合前状态到融合后状态的转变中发挥重要作用。MERS-CoV S蛋白的NTD可以作为中和抗体的关键表位。
具有强效中和活性的靶向SARS-CoV-2 S蛋白的单克隆抗体(mAb)是开发COVID-19治疗干预的一个重点。许多研究报道了靶向RBD和抑制S蛋白与ACE2之间结合的SARS-CoV-2中和抗体的功能和结构。使用单一的RBD靶向抗体可能会诱发冠状病毒产生抵抗性突变。靶向非RBD表位的抗体可能被添加到针对SARS-CoV-2的抗体组合疗法中。
不仅位于S蛋白的RBD上的表位分布,而且位于整个S蛋白上的表位分布都可用来指导开发靶向SARS-CoV-2的治疗性药物。在一项新的研究中,来自中国军事医学科学院、西湖大学和清华大学的研究人员从10名康复期COVID-19患者中分离并描述了mAb。相关研究结果于2020年6月22日在线发表在Science期刊上,论文标题为“A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2”。
他们分离出的三种mAb显示出对真正的SARS-CoV-2的中和活性。一种名为4A8的mAb对真正的SARS-CoV-2和SARS-CoV-2假病毒都有较高的中和效力,但并不结合RBD。他们解析出4A8与S蛋白结合在一起时的总体分辨率为3.1埃的低温电镜结构和针对4A8-NTD界面的局部分辨率为3.3埃的低温电镜结构,从而确定4A8的表位为S蛋白的NTD。这表明NTD是针对COVID-19的治疗性mAb的一个有希望的靶点。
4.Science:在COVID-19疫情期间,中国采取的封锁措施导致污染排放大幅减少,但局部地区仍出现严重雾霾
doi:10.1126/science.abb7431
COVID-19封锁导致全球空气质量改善的病毒前后图像可能无法描绘出完全准确的画面,至少在中国是这样。在一项新的研究中,来自中国科学院地球环境研究所和美国加州理工学院的研究人员报道,虽然在封锁期间污染排放有了大幅减少,远远超过了中国在北京奥运会前用于临时治理空气污染的“奥运蓝”努力,但是其他涉及复杂大气化学和气象变化的因素抵消了减排的影响。这导致北京和中国北方其他城市在COVID-19封锁期间的空气质量出现了反常的恶化。相关研究结果于2020年6月17日在线发表在Science期刊上,论文标题为“Unexpected air pollution with marked emission reductions during the COVID-19 outbreak in China”。
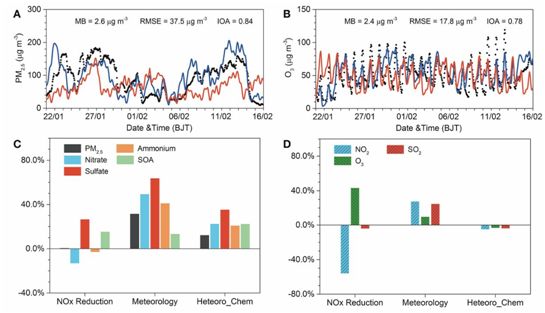
这些研究人员查阅了该地区的卫星和地面观测数据,并进行了最先进的大气模型模拟。他们重点研究了2020年1月23日至2月13日之间大约三周的时间,当时中国封锁了它的城市---首先是武汉市(在中国中部),在那里出现了导致COVID-19的新型冠状病毒,然后是全国其他地区---努力减缓感染的蔓延。
在此期间,在中国观察到某些类型的气体排放减少了高达90%,如二氧化氮(NO2)。但令人惊讶的是,在封锁期间,中国北方同时出现了严重的雾霾污染。
5.Science:靶向SARS-CoV-2刺突蛋白的抗体组合可阻止单一抗体治疗时快速产生的逃逸突变
doi:10.1126/science.abd0831
科学家们最近利用基因人源化的小鼠和来自恢复期患者的B细胞,产生了一个非常大的靶向SARS-CoV-2 S蛋白的受体结合结构域(RBD)的高强效全人中和抗体的集合。产生这个非常大的集合的预期目标是筛选成对可以同时结合S蛋白的RBD的高强效抗体,因此它们可能构成治疗性的抗体混合物,不仅可以成为一种有效的治疗,而且也可能防止为了应对单一抗体治疗的选择性压力而产生的病毒逃逸突变体引起的抗体抵抗性。
在一项新的研究中,为了评估再生元制药公司(Regeneron Pharmaceuticals)近期描述的抗病毒抗体对截至2020年3月底已确定的可公开获得的SARS-CoV-2序列(代表超过7000个独特的基因组)所代表的一系列S蛋白RBD突变体的有效性,该公司的研究人员使用了表达这些SARS-CoV-2 S蛋白突变体的VSV假颗粒系统。他们的前八种中和抗体都可有效地抵抗所有测试的突变体,从而展示了对在人类中传播的SARS-CoV-2的广泛覆盖。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies”。
这项研究描述的数据有力地支持了这样一个概念,即抗体组合疗法可能提供一个强大的方法,以最大限度地减少SARS-CoV-2的突变逃逸;特别是,这些研究人员的研究指出了抗体组合治疗---选择两种结合独特的非重叠的病毒靶标区域(就这项研究而言,S蛋白的RBD),因而需要在两个不同的遗传位点同时发生不太可能发生的突变以便病毒逃逸---的潜在价值。临床候选广效性的选择标准,包括针对自然循环序列变异的功能评估,以及包含具有非重叠表位的多种抗体,可以提供增强的保护,防止疗效丧失。未来的体内动物和人类临床研究需要密切关注可能出现的逃逸突变体和潜在的后续药效损失。广泛强效的候选抗体的临床标准,包括针对自然循环序列变异的功能评估,以及包含多种结合表位不存在重叠的抗体,可能提供增强的保护,防止失效。未来的体内动物和人体临床研究需要密切关注可能出现的逃逸突变体以及随后可能发生的药物疗效丧失。
6.Science:利用来自COVID-19患者的强效中和抗体鉴定出新冠病毒的多个脆弱靶标
doi:10.1126/science.abc5902
在一项新的研究中,来自荷兰阿姆斯特丹大学、伊拉斯莫斯医学中心、美国斯克里普斯研究所和康奈尔大学威尔医学院的研究人员利用来自SARS-CoV-2的稳定化融合前刺突蛋白,从3名康复期患者中分离出18种中和抗体(NAb)。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Potent neutralizing antibodies from COVID-19 patients define multiple targets of vulnerability”。
这些抗体具有低水平的体细胞高频突变(somatic hypermutation),并且在VH1-69、VH3-30-3和VH1-24基因的使用中表现出较强的富集。其中的一小部分抗体在低至0.007μg/mL时就能够强效地抑制真正的SARS-CoV-2感染。竞争和电镜研究说明SARS-CoV-2 S蛋白含有多个不同的抗原位点,包括多个受体结合结构域(RBD)表位以及非RBD表位。除了为疫苗设计提供指导外,这些抗体也是COVID-19治疗和预防的有希望的候选药物。
这18种靶向S蛋白上不同的抗原位点,其中的两种中和抗体对真正的SARS-CoV-2病毒具有皮摩尔中和活性(IC50分别为0.007和0.009μg/mL,或者说47和60pM)。
7.Science:发现有潜力治疗COVID-19的强效抗体组合
doi:10.1126/science.abd0827
在一项新的研究中,来自美国马里兰大学医学院等研究机构的研究人员评估了几种人类抗体,以确定最有效的组合并将这种组合作为一种有前景的抗病毒疗法来抵抗导致COVID-19的新型冠状病毒SARS-CoV-2。这项研究展示了利用基因工程小鼠和来自康复的COVID-19患者的血浆,快速分离、测试和大规模产生针对任何传染病的抗体药物的过程。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail”。
为了产生用于对抗COVID-19的抗体组合中的所谓单克隆抗体,这些研究人员首先需要确定哪些抗体能够最有效地对抗这种新型冠状病毒。他们评估了四种最有效的抗体,以确定每种抗体中和SARS-CoV-2病毒的潜力。他们确定了两种抗体当组合使用时会形成最强有力的组合。
目前,含有这两种抗体的抗体组合正在由Regeneron公司赞助的一项新的临床试验中进行测试,该临床试验将探究这种抗体疗法是否能改善COVID-19患者(住院患者和非住院患者)的预后。它还将作为一种预防性疗法,在那些健康但因在医疗保健环境中工作或接触过感染者而具有高患病风险的人体中进行测试。
8.Science: COVID-19中和抗体显示治疗潜力
doi:10.1126/science.abc7520
在最近的一项研究中,Scripps研究所的研究者们通过对动物和人类细胞进行测试,发现已康复的COVID-19患者的血液中的抗体可对SARS-CoV-2提供强有力的保护。相关结果发表在最近的《Science》杂志上,这项研究为抗体的临床试验和附加测试奠定了基础。
文章作者Rogers等人从轻度到重度COVID-19康复的患者中采集了血液样本。同时,Scripps Research和IAVI的科学家合作开发了表达ACE2的细胞。在一组初步实验中,研究小组测试了来自患者的血液样本是否能与病毒结合并阻止其感染细胞。之后,科学家分离出1000多种不同的产生抗体的B细胞,进而从这些B细胞中获得了抗体基因序列,以便可以在实验室中产生抗体。通过单独筛选这些抗体,研究小组确定了几种可以阻断病毒的候选物。
所有这些工作-包括细胞和动物感染模型的开发,以及发现目标抗体与病毒结合的位置的研究-都在不到七个星期的时间内完成。研究人员说,如果进一步的动物安全性试验和人的临床试验进展顺利,那么最早在明年一月就可以在临床中使用。
9.Science:来自康复的SRAS患者的人类单克隆抗体可交叉中和SARS样冠状病毒
doi:10.1126/science.abc7424
人们迫切需要针对已知和未出现的人类冠状病毒(HCoV)的广泛保护性疫苗。为了更深入地了解交叉中和抗体反应,在一项新的研究中,美国研究人员分析了一名康复的SRAS供者的记忆B细胞库,发现了200种靶向S蛋白表面上多个保守性位点的SARS-CoV-2结合抗体。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Broad neutralization of SARS-related viruses by human monoclonal antibodies”。
这些非中和抗体中的很大一部分显示出高水平的体细胞高频突变,并且与人体中传播的HCoV发生交叉反应,这让人回忆起先前HCoV感染引起记忆B细胞的事先存在。几种抗体通过阻断受体附着和诱导S1亚基脱落,有效地交叉中和SARS-CoV、SARS-CoV-2和蝙蝠SARS样冠状病毒WIV1。这些抗体为治疗性干预提供了很有前途的候选药物,并为合理设计泛sarbecovirus病毒疫苗提供了靶点。
这些强效的交叉中和抗体结合的保守表位与hACE2结合位点存在重叠,这揭示了这种抗原表面是合理设计泛sarbecovirus病毒疫苗的一个有希望的靶点。比如,这类抗体所确定的RBD表位可以呈现在构象稳定的蛋白支架上,从而将抗体反应集中在这个位点上。此外,这些人类抗体,不论是单独使用还是组合使用,都代表有希望的候选药物,可用于预防或治疗SARS、COVID-19,以及新出现的SARS类冠状病毒在未来引起的潜在疾病。
10.Science:协助对抗病毒感染的干扰素λ也会阻碍肺部损伤的修复
doi:10.1126/science.abc2061; doi:10.1126/science.abd2208
在一项新的研究中,来自英国弗朗西斯克里克研究所等研究机构的研究人员发现一种最初有助于人体对病毒产生免疫反应的蛋白随后会干扰肺部组织的修复。这项研究突显需要仔细考虑使用这种蛋白治疗包括冠状病毒在内的病毒感染。相关研究结果于2020年6月11日在线发表在Science期刊上,论文标题为“Type I and III interferons disrupt lung epithelial repair during recovery from viral infection”。
当病毒感染肺部时,身体会试图自我防御,抵御感染。一种防御机制是激活一种称为干扰素λ(IFN-λ)的蛋白,它向周围的肺组织细胞发出信号,开启抗病毒防御。
他们观察到,在患有流感的小鼠中,它们的肺部中这种蛋白的水平增加了,这意味着它们的上皮细胞增殖减少。这些细胞组成了肺部含气部分(airspaces)的内膜,需要增殖来替换受损细胞和修复损伤。不论是实验性地用IFN-λ处理小鼠,还是自然产生IFN-λ的小鼠,他们都获得类似的结果,这是因为它们对病毒感染作出反应。此外,用这种蛋白处理过的人肺部上皮细胞的培养物也不太能够生长。
论文通讯作者、弗朗西斯克里克研究所免疫调节实验室团队领导Andreas Wack说,“这是一种真正有效的蛋白,具有许多不同的功能。在病毒感染初期,它具有保护作用,可激活有助于抵抗病毒的功能。但是,如果它在组织中停留的时间过长,可能会变得有害。这意味着,对于任何使用这种蛋白的抗病毒治疗,都必须保持一个非常谨慎的平衡。临床医生应该考虑治疗的时机(越早越好)以及治疗的持续时间。”
11.Science:干扰素IFN-λ在COVID-19中有益还是有害?新研究发现它在识别病毒后会破坏肺部表面屏障
doi:10.1126/science.abc3545; doi:10.1126/science.abd2208
免疫系统产生的干扰素和其他细胞因子是抵御病毒感染的重要防御手段,但正如我们在COVID-19中看到的那样,它们也会导致破坏性的、可能危及生命的肺部炎症。最近的证据提示着一种称为III型干扰素或干扰素λ(IFN-λ)的干扰素可以对抗病毒感染,同时限制这种炎症损伤。这导致人们开展临床试验来测试III型干扰素是否可用来治疗COVID-19。
不过,在一项新的研究中,来自意大利和美国的研究人员提供证据表明III型干扰素可以增加肺部出现危及生命的细菌“超级感染”风险。在流感和COVID-19中均可发生超级感染。这些研究人员提醒道,在COVID-19病程后期给予III型干扰素可能弊大于利。相关研究结果于2020年6月11日在线发表在Science期刊上,论文标题为“Type III interferons disrupt the lung epithelial barrier upon viral recognition”。
论文通讯作者、美国波士顿儿童医院免疫学家Ivan Zanoni博士说,“我们的数据表明,SARS-CoV-2抑制了上呼吸道中干扰素的产生,削弱了免疫反应,帮助这种冠状病毒存活。但是,当这种冠状病毒到达下呼吸道时,会出现旺盛的免疫反应,包括Ⅲ型干扰素上调,我们认为这是有害的。”
12.Science:基因组监测显示SARS-CoV-2在美国加州北部的多次输入
doi:10.1126/science.abb9263
来自美国多家研究机构的研究人员近期开发出一种称为宏基因组测序辅以掺入引物富集技术(Metagenomic Sequencing with Spiked Primer Enrichment, MSSPE)的方法,以便直接从临床样本中快速富集和组装病毒基因组。在一项新的研究中,他们利用这种方法和/或瓦片多重PCR(tiling multiplex PCR)从加州北部的COVID-19患者中获得病毒基因组并进行系统发育分析,以更好地了解美国SARS-CoV-2的遗传多样性和病毒谱系在社区中传播的性质。相关研究结果于2020年6月8日在线发表在Science期刊上,论文标题为“Genomic surveillance reveals multiple introductions of SARS-CoV-2 into Northern California”。
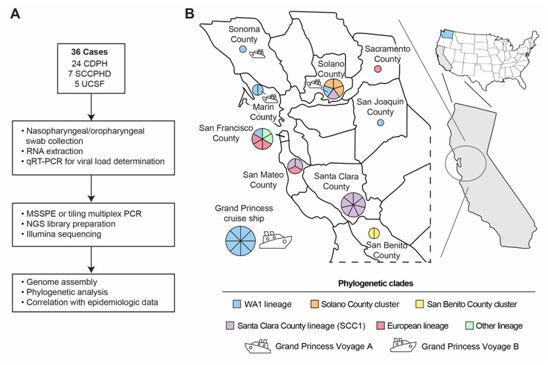
系统发育分析显示,这项研究中产生的来自加州的36个SARS-CoV-2基因组分散在SARS-CoV-2的进化树上,该进化树是由截至2020年3月20日存入GISAID的789个来自全球的病毒基因组建立的。这36个基因组包括14个华盛顿州(WA1)谱系,10个与圣克拉拉县聚集性疫情相关的谱系(以下简称SCC1谱系),3个来自索拉诺县的3例病例,5个与在欧洲和纽约流传的谱系相关,4个与来自武汉或中国其他地区的早期谱系相关(包括2例来自圣贝尼托县的患者,具有相同的病毒基因组)。
13.Science:揭示纽约市首批确诊的COVID-19病例主要来源于欧洲和美国其他地方,而并非中国
doi:10.1126/science.abc1917
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员首次对SARS-CoV-2进行分子流行病学研究,发现美国纽约市首批确诊的COVID-19病例主要来源于欧洲和美国其他地方。相关研究结果于2020年5月29日在线发表在Science期刊上,论文标题为“Introductions and early spread of SARS-CoV-2 in the New York City area”。
这项研究首次追踪了这些病例的来源,并表明纽约市的SARS-CoV-2疫情主要是通过美国和欧洲之间未经追踪的传播引起的,而支持从中国或亚洲其他地方直接引入的证据并不充分。这些研究人员还记录了在此期间SARS-CoV-2在纽约市的早期社区传播。
纽约市已经成为美国SARS-CoV-2感染的主要疫情中心之一,在这个大都市地区有近17000人死亡。了解这种病毒何时来到纽约,以及它的传播路线,对于评估和设计遏制策略至关重要。
14.Science:定量确定不同的干预措施对COVID-19病例数量的影响
doi:10.1126/science.abb9789
在一项新的研究中,来自德国马克斯-普朗克动力学与自组织研究所和哥廷根大学的研究人员如今成功地分析了与过去的遏制措施有关的德国COVID-19病例数量,并得出了未来几周的情况。他们的计算机模型还可以为其他国家采取干预措施的有效性提供新的见解。相关研究结果于2020年5月15日在线发表在Science期刊上,论文标题为“Inferring change points in the spread of COVID-19 reveals the effectiveness of interventions”。
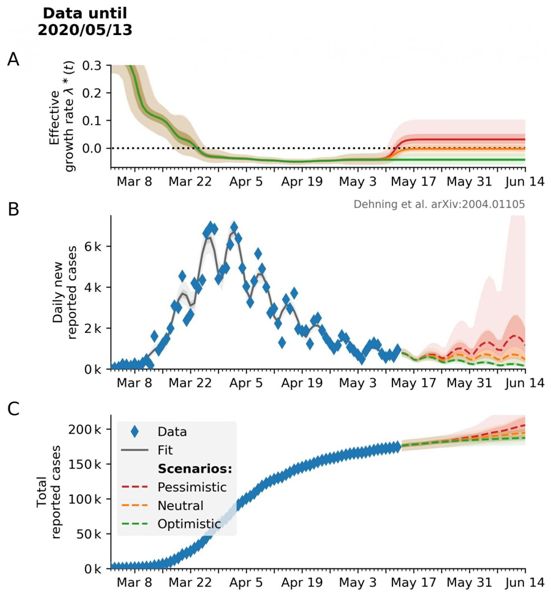
目前,许多人都在关注最近几周内遏制疫情的干预措施效果如何,以及未来几周事态将如何发展。马克斯-普朗克动力学与自组织研究所的科学家们一直在研究这些问题。他们从3月中旬开始,就与哥廷根大学的科学家们一起,对德国的新冠病毒疫情过程进行了模拟。在他们的模型计算中,这些研究人员将3月份逐渐增加的公共生活限制与COVID-19病例数的发展联系起来。特别是,他们研究了3月份的三套干预措施的影响:3月8日左右取消大型公共活动,3月16日关闭教育机构和许多商店,3月22日大范围的禁止接触。
为此,这些研究人员将COVID-19新感染的时间过程数据与流行病学动力学模型相结合,分析了迄今为止的疫情发展过程,并对未来的情景进行了研究。根据计算机模型,一揽子遏制措施最初减缓了COVID-19的传播速度,最终阻止了可怕的指数式增长。论文通讯作者、马克斯-普朗克动力学与自组织研究所小组负责人Viola Priesemann说,“我们的分析清楚地显示了各种干预措施的效果,这些干预措施最终共同导致了强烈的趋势逆转。因此,我们的模型计算向我们展示了与干预措施密切相关的人们行为变化的整体影响。”(生物谷 Bioon.com)

SARS-CoV-2(之前称为2019-nCoV)的透射电镜图,图片来自NIAID RML。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Science期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Science:揭示病情较重的COVID-19患者存在三种不同的免疫反应
doi:10.1126/science.abc8511
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现针对SARS-CoV-2感染的三种不同的免疫反应,这可能有助于预测重症COVID-19患者的疾病轨迹,并可能最终为如何最好地治疗他们提供信息。相关研究结果于2020年7月15日在线发表在Science期刊上,论文标题为“Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications”。

图片来自Science, 2020, doi:10.1126/science.abc8511。
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院系统药理学与转化治疗学系主任E. John Wherry博士说,“对于住院的COVID-19患者,免疫系统的反应方式并不只有一种。有很多异质性,我们将其归纳为我们所说的三种‘免疫型(immunotype)’。我们希望我们可能真地能够根据临床数据预测,或者至少推断出患者具有的不同免疫模式。这将使我们能够开始考虑让患者参加不同类型的临床试验。”
2.Science:新研究指出针对新冠肺炎而言,实现群体免疫的门槛下降了
doi:10.1126/science.abc6810
根据一项新的研究,在比以前估计的感染人数更少的情况下,可以实现对COVID-19的群体免疫(herd immunity)。
在这项新的研究中,来自英国诺丁汉大学和瑞典斯德哥尔摩大学的研究人员设计了一种简单的模型,将人分为反映年龄和社会活动水平的群体。当年龄和社会活动的差异被纳入这种模型时,群体免疫水平从60%降低到43%。43%这个数字应该被解释为一个例子,而不是一个确切的数值,甚至是最好的估计。相关研究结果于2020年6月23日在线发表在Science期刊上,论文标题为“A mathematical model reveals the influence of population heterogeneity on herd immunity to SARS-CoV-2”。
这项研究采用一种新的数学方法来估计人群对诸如当前的COVID-19大流行之类的传染病的群体免疫水平。群体免疫水平的定义是,当所有预防措施(如社会隔离)被取消后,为了使得疾病传播下降和停止,必须产生免疫力的人口比例。就COVID-19而言,人们经常说这一数字约为60%,这一数字是根据为防止大规模疫情爆发而必须接种疫苗(在流行病发生前)的那部分人口得出的。
论文共同作者、诺丁汉大学的Frank Ball教授解释道,“通过采用这种新的数学方法来估计实现群体免疫的人群比例,我们发现这有可能被降低到43%,而且这种降低主要是由于活动水平而不是年龄结构引起的。因此,社会活跃度越高的个体比社会活跃度较低的个体更容易被感染,而且如果他们被感染,他们也更容易感染人。结果就是,相比于通过接种疫苗获得的免疫水平,当免疫力由疾病传播引起时,群体免疫水平要低一些。我们的研究结果对当前COVID-19大流行和解除封锁有潜在的影响,并表明个体差异(如活动水平)是指导政策的模型中应包含的重要特征。”
3.Science:我国科学家发现人中和抗体结合SARS-CoV-2刺突蛋白的N端结构域
doi:10.1126/science.abc6952
三聚体刺突蛋白(S蛋白)装饰着冠状病毒的表面,在病毒进入过程中起着关键作用。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD,1-1208个氨基酸)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。RBD负责与ACE2结合,而NTD的功能尚不十分清楚。在一些冠状病毒中,NTD可能在初始附着时识别特定的糖基团,并可能在S蛋白从融合前状态到融合后状态的转变中发挥重要作用。MERS-CoV S蛋白的NTD可以作为中和抗体的关键表位。
具有强效中和活性的靶向SARS-CoV-2 S蛋白的单克隆抗体(mAb)是开发COVID-19治疗干预的一个重点。许多研究报道了靶向RBD和抑制S蛋白与ACE2之间结合的SARS-CoV-2中和抗体的功能和结构。使用单一的RBD靶向抗体可能会诱发冠状病毒产生抵抗性突变。靶向非RBD表位的抗体可能被添加到针对SARS-CoV-2的抗体组合疗法中。
不仅位于S蛋白的RBD上的表位分布,而且位于整个S蛋白上的表位分布都可用来指导开发靶向SARS-CoV-2的治疗性药物。在一项新的研究中,来自中国军事医学科学院、西湖大学和清华大学的研究人员从10名康复期COVID-19患者中分离并描述了mAb。相关研究结果于2020年6月22日在线发表在Science期刊上,论文标题为“A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2”。
他们分离出的三种mAb显示出对真正的SARS-CoV-2的中和活性。一种名为4A8的mAb对真正的SARS-CoV-2和SARS-CoV-2假病毒都有较高的中和效力,但并不结合RBD。他们解析出4A8与S蛋白结合在一起时的总体分辨率为3.1埃的低温电镜结构和针对4A8-NTD界面的局部分辨率为3.3埃的低温电镜结构,从而确定4A8的表位为S蛋白的NTD。这表明NTD是针对COVID-19的治疗性mAb的一个有希望的靶点。
4.Science:在COVID-19疫情期间,中国采取的封锁措施导致污染排放大幅减少,但局部地区仍出现严重雾霾
doi:10.1126/science.abb7431
COVID-19封锁导致全球空气质量改善的病毒前后图像可能无法描绘出完全准确的画面,至少在中国是这样。在一项新的研究中,来自中国科学院地球环境研究所和美国加州理工学院的研究人员报道,虽然在封锁期间污染排放有了大幅减少,远远超过了中国在北京奥运会前用于临时治理空气污染的“奥运蓝”努力,但是其他涉及复杂大气化学和气象变化的因素抵消了减排的影响。这导致北京和中国北方其他城市在COVID-19封锁期间的空气质量出现了反常的恶化。相关研究结果于2020年6月17日在线发表在Science期刊上,论文标题为“Unexpected air pollution with marked emission reductions during the COVID-19 outbreak in China”。

图片来自Science, 2020, doi:10.1126/science.abb7431。
这些研究人员查阅了该地区的卫星和地面观测数据,并进行了最先进的大气模型模拟。他们重点研究了2020年1月23日至2月13日之间大约三周的时间,当时中国封锁了它的城市---首先是武汉市(在中国中部),在那里出现了导致COVID-19的新型冠状病毒,然后是全国其他地区---努力减缓感染的蔓延。
在此期间,在中国观察到某些类型的气体排放减少了高达90%,如二氧化氮(NO2)。但令人惊讶的是,在封锁期间,中国北方同时出现了严重的雾霾污染。
5.Science:靶向SARS-CoV-2刺突蛋白的抗体组合可阻止单一抗体治疗时快速产生的逃逸突变
doi:10.1126/science.abd0831
科学家们最近利用基因人源化的小鼠和来自恢复期患者的B细胞,产生了一个非常大的靶向SARS-CoV-2 S蛋白的受体结合结构域(RBD)的高强效全人中和抗体的集合。产生这个非常大的集合的预期目标是筛选成对可以同时结合S蛋白的RBD的高强效抗体,因此它们可能构成治疗性的抗体混合物,不仅可以成为一种有效的治疗,而且也可能防止为了应对单一抗体治疗的选择性压力而产生的病毒逃逸突变体引起的抗体抵抗性。
在一项新的研究中,为了评估再生元制药公司(Regeneron Pharmaceuticals)近期描述的抗病毒抗体对截至2020年3月底已确定的可公开获得的SARS-CoV-2序列(代表超过7000个独特的基因组)所代表的一系列S蛋白RBD突变体的有效性,该公司的研究人员使用了表达这些SARS-CoV-2 S蛋白突变体的VSV假颗粒系统。他们的前八种中和抗体都可有效地抵抗所有测试的突变体,从而展示了对在人类中传播的SARS-CoV-2的广泛覆盖。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies”。
这项研究描述的数据有力地支持了这样一个概念,即抗体组合疗法可能提供一个强大的方法,以最大限度地减少SARS-CoV-2的突变逃逸;特别是,这些研究人员的研究指出了抗体组合治疗---选择两种结合独特的非重叠的病毒靶标区域(就这项研究而言,S蛋白的RBD),因而需要在两个不同的遗传位点同时发生不太可能发生的突变以便病毒逃逸---的潜在价值。临床候选广效性的选择标准,包括针对自然循环序列变异的功能评估,以及包含具有非重叠表位的多种抗体,可以提供增强的保护,防止疗效丧失。未来的体内动物和人类临床研究需要密切关注可能出现的逃逸突变体和潜在的后续药效损失。广泛强效的候选抗体的临床标准,包括针对自然循环序列变异的功能评估,以及包含多种结合表位不存在重叠的抗体,可能提供增强的保护,防止失效。未来的体内动物和人体临床研究需要密切关注可能出现的逃逸突变体以及随后可能发生的药物疗效丧失。
6.Science:利用来自COVID-19患者的强效中和抗体鉴定出新冠病毒的多个脆弱靶标
doi:10.1126/science.abc5902
在一项新的研究中,来自荷兰阿姆斯特丹大学、伊拉斯莫斯医学中心、美国斯克里普斯研究所和康奈尔大学威尔医学院的研究人员利用来自SARS-CoV-2的稳定化融合前刺突蛋白,从3名康复期患者中分离出18种中和抗体(NAb)。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Potent neutralizing antibodies from COVID-19 patients define multiple targets of vulnerability”。
这些抗体具有低水平的体细胞高频突变(somatic hypermutation),并且在VH1-69、VH3-30-3和VH1-24基因的使用中表现出较强的富集。其中的一小部分抗体在低至0.007μg/mL时就能够强效地抑制真正的SARS-CoV-2感染。竞争和电镜研究说明SARS-CoV-2 S蛋白含有多个不同的抗原位点,包括多个受体结合结构域(RBD)表位以及非RBD表位。除了为疫苗设计提供指导外,这些抗体也是COVID-19治疗和预防的有希望的候选药物。
这18种靶向S蛋白上不同的抗原位点,其中的两种中和抗体对真正的SARS-CoV-2病毒具有皮摩尔中和活性(IC50分别为0.007和0.009μg/mL,或者说47和60pM)。
7.Science:发现有潜力治疗COVID-19的强效抗体组合
doi:10.1126/science.abd0827
在一项新的研究中,来自美国马里兰大学医学院等研究机构的研究人员评估了几种人类抗体,以确定最有效的组合并将这种组合作为一种有前景的抗病毒疗法来抵抗导致COVID-19的新型冠状病毒SARS-CoV-2。这项研究展示了利用基因工程小鼠和来自康复的COVID-19患者的血浆,快速分离、测试和大规模产生针对任何传染病的抗体药物的过程。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail”。
为了产生用于对抗COVID-19的抗体组合中的所谓单克隆抗体,这些研究人员首先需要确定哪些抗体能够最有效地对抗这种新型冠状病毒。他们评估了四种最有效的抗体,以确定每种抗体中和SARS-CoV-2病毒的潜力。他们确定了两种抗体当组合使用时会形成最强有力的组合。
目前,含有这两种抗体的抗体组合正在由Regeneron公司赞助的一项新的临床试验中进行测试,该临床试验将探究这种抗体疗法是否能改善COVID-19患者(住院患者和非住院患者)的预后。它还将作为一种预防性疗法,在那些健康但因在医疗保健环境中工作或接触过感染者而具有高患病风险的人体中进行测试。
8.Science: COVID-19中和抗体显示治疗潜力
doi:10.1126/science.abc7520
在最近的一项研究中,Scripps研究所的研究者们通过对动物和人类细胞进行测试,发现已康复的COVID-19患者的血液中的抗体可对SARS-CoV-2提供强有力的保护。相关结果发表在最近的《Science》杂志上,这项研究为抗体的临床试验和附加测试奠定了基础。

图片来自NIAID-RML。
文章作者Rogers等人从轻度到重度COVID-19康复的患者中采集了血液样本。同时,Scripps Research和IAVI的科学家合作开发了表达ACE2的细胞。在一组初步实验中,研究小组测试了来自患者的血液样本是否能与病毒结合并阻止其感染细胞。之后,科学家分离出1000多种不同的产生抗体的B细胞,进而从这些B细胞中获得了抗体基因序列,以便可以在实验室中产生抗体。通过单独筛选这些抗体,研究小组确定了几种可以阻断病毒的候选物。
所有这些工作-包括细胞和动物感染模型的开发,以及发现目标抗体与病毒结合的位置的研究-都在不到七个星期的时间内完成。研究人员说,如果进一步的动物安全性试验和人的临床试验进展顺利,那么最早在明年一月就可以在临床中使用。
9.Science:来自康复的SRAS患者的人类单克隆抗体可交叉中和SARS样冠状病毒
doi:10.1126/science.abc7424
人们迫切需要针对已知和未出现的人类冠状病毒(HCoV)的广泛保护性疫苗。为了更深入地了解交叉中和抗体反应,在一项新的研究中,美国研究人员分析了一名康复的SRAS供者的记忆B细胞库,发现了200种靶向S蛋白表面上多个保守性位点的SARS-CoV-2结合抗体。相关研究结果于2020年6月15日在线发表在Science期刊上,论文标题为“Broad neutralization of SARS-related viruses by human monoclonal antibodies”。
这些非中和抗体中的很大一部分显示出高水平的体细胞高频突变,并且与人体中传播的HCoV发生交叉反应,这让人回忆起先前HCoV感染引起记忆B细胞的事先存在。几种抗体通过阻断受体附着和诱导S1亚基脱落,有效地交叉中和SARS-CoV、SARS-CoV-2和蝙蝠SARS样冠状病毒WIV1。这些抗体为治疗性干预提供了很有前途的候选药物,并为合理设计泛sarbecovirus病毒疫苗提供了靶点。
这些强效的交叉中和抗体结合的保守表位与hACE2结合位点存在重叠,这揭示了这种抗原表面是合理设计泛sarbecovirus病毒疫苗的一个有希望的靶点。比如,这类抗体所确定的RBD表位可以呈现在构象稳定的蛋白支架上,从而将抗体反应集中在这个位点上。此外,这些人类抗体,不论是单独使用还是组合使用,都代表有希望的候选药物,可用于预防或治疗SARS、COVID-19,以及新出现的SARS类冠状病毒在未来引起的潜在疾病。
10.Science:协助对抗病毒感染的干扰素λ也会阻碍肺部损伤的修复
doi:10.1126/science.abc2061; doi:10.1126/science.abd2208
在一项新的研究中,来自英国弗朗西斯克里克研究所等研究机构的研究人员发现一种最初有助于人体对病毒产生免疫反应的蛋白随后会干扰肺部组织的修复。这项研究突显需要仔细考虑使用这种蛋白治疗包括冠状病毒在内的病毒感染。相关研究结果于2020年6月11日在线发表在Science期刊上,论文标题为“Type I and III interferons disrupt lung epithelial repair during recovery from viral infection”。
当病毒感染肺部时,身体会试图自我防御,抵御感染。一种防御机制是激活一种称为干扰素λ(IFN-λ)的蛋白,它向周围的肺组织细胞发出信号,开启抗病毒防御。
他们观察到,在患有流感的小鼠中,它们的肺部中这种蛋白的水平增加了,这意味着它们的上皮细胞增殖减少。这些细胞组成了肺部含气部分(airspaces)的内膜,需要增殖来替换受损细胞和修复损伤。不论是实验性地用IFN-λ处理小鼠,还是自然产生IFN-λ的小鼠,他们都获得类似的结果,这是因为它们对病毒感染作出反应。此外,用这种蛋白处理过的人肺部上皮细胞的培养物也不太能够生长。
论文通讯作者、弗朗西斯克里克研究所免疫调节实验室团队领导Andreas Wack说,“这是一种真正有效的蛋白,具有许多不同的功能。在病毒感染初期,它具有保护作用,可激活有助于抵抗病毒的功能。但是,如果它在组织中停留的时间过长,可能会变得有害。这意味着,对于任何使用这种蛋白的抗病毒治疗,都必须保持一个非常谨慎的平衡。临床医生应该考虑治疗的时机(越早越好)以及治疗的持续时间。”
11.Science:干扰素IFN-λ在COVID-19中有益还是有害?新研究发现它在识别病毒后会破坏肺部表面屏障
doi:10.1126/science.abc3545; doi:10.1126/science.abd2208
免疫系统产生的干扰素和其他细胞因子是抵御病毒感染的重要防御手段,但正如我们在COVID-19中看到的那样,它们也会导致破坏性的、可能危及生命的肺部炎症。最近的证据提示着一种称为III型干扰素或干扰素λ(IFN-λ)的干扰素可以对抗病毒感染,同时限制这种炎症损伤。这导致人们开展临床试验来测试III型干扰素是否可用来治疗COVID-19。
不过,在一项新的研究中,来自意大利和美国的研究人员提供证据表明III型干扰素可以增加肺部出现危及生命的细菌“超级感染”风险。在流感和COVID-19中均可发生超级感染。这些研究人员提醒道,在COVID-19病程后期给予III型干扰素可能弊大于利。相关研究结果于2020年6月11日在线发表在Science期刊上,论文标题为“Type III interferons disrupt the lung epithelial barrier upon viral recognition”。
论文通讯作者、美国波士顿儿童医院免疫学家Ivan Zanoni博士说,“我们的数据表明,SARS-CoV-2抑制了上呼吸道中干扰素的产生,削弱了免疫反应,帮助这种冠状病毒存活。但是,当这种冠状病毒到达下呼吸道时,会出现旺盛的免疫反应,包括Ⅲ型干扰素上调,我们认为这是有害的。”
12.Science:基因组监测显示SARS-CoV-2在美国加州北部的多次输入
doi:10.1126/science.abb9263
来自美国多家研究机构的研究人员近期开发出一种称为宏基因组测序辅以掺入引物富集技术(Metagenomic Sequencing with Spiked Primer Enrichment, MSSPE)的方法,以便直接从临床样本中快速富集和组装病毒基因组。在一项新的研究中,他们利用这种方法和/或瓦片多重PCR(tiling multiplex PCR)从加州北部的COVID-19患者中获得病毒基因组并进行系统发育分析,以更好地了解美国SARS-CoV-2的遗传多样性和病毒谱系在社区中传播的性质。相关研究结果于2020年6月8日在线发表在Science期刊上,论文标题为“Genomic surveillance reveals multiple introductions of SARS-CoV-2 into Northern California”。

对加州北部的SARS-CoV-2基因组调查。图片来自Science, 2020, doi:10.1126/science.abb9263。
系统发育分析显示,这项研究中产生的来自加州的36个SARS-CoV-2基因组分散在SARS-CoV-2的进化树上,该进化树是由截至2020年3月20日存入GISAID的789个来自全球的病毒基因组建立的。这36个基因组包括14个华盛顿州(WA1)谱系,10个与圣克拉拉县聚集性疫情相关的谱系(以下简称SCC1谱系),3个来自索拉诺县的3例病例,5个与在欧洲和纽约流传的谱系相关,4个与来自武汉或中国其他地区的早期谱系相关(包括2例来自圣贝尼托县的患者,具有相同的病毒基因组)。
13.Science:揭示纽约市首批确诊的COVID-19病例主要来源于欧洲和美国其他地方,而并非中国
doi:10.1126/science.abc1917
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员首次对SARS-CoV-2进行分子流行病学研究,发现美国纽约市首批确诊的COVID-19病例主要来源于欧洲和美国其他地方。相关研究结果于2020年5月29日在线发表在Science期刊上,论文标题为“Introductions and early spread of SARS-CoV-2 in the New York City area”。
这项研究首次追踪了这些病例的来源,并表明纽约市的SARS-CoV-2疫情主要是通过美国和欧洲之间未经追踪的传播引起的,而支持从中国或亚洲其他地方直接引入的证据并不充分。这些研究人员还记录了在此期间SARS-CoV-2在纽约市的早期社区传播。
纽约市已经成为美国SARS-CoV-2感染的主要疫情中心之一,在这个大都市地区有近17000人死亡。了解这种病毒何时来到纽约,以及它的传播路线,对于评估和设计遏制策略至关重要。
14.Science:定量确定不同的干预措施对COVID-19病例数量的影响
doi:10.1126/science.abb9789
在一项新的研究中,来自德国马克斯-普朗克动力学与自组织研究所和哥廷根大学的研究人员如今成功地分析了与过去的遏制措施有关的德国COVID-19病例数量,并得出了未来几周的情况。他们的计算机模型还可以为其他国家采取干预措施的有效性提供新的见解。相关研究结果于2020年5月15日在线发表在Science期刊上,论文标题为“Inferring change points in the spread of COVID-19 reveals the effectiveness of interventions”。

图片来自Science, 2020, doi:10.1126/science.abb789。
目前,许多人都在关注最近几周内遏制疫情的干预措施效果如何,以及未来几周事态将如何发展。马克斯-普朗克动力学与自组织研究所的科学家们一直在研究这些问题。他们从3月中旬开始,就与哥廷根大学的科学家们一起,对德国的新冠病毒疫情过程进行了模拟。在他们的模型计算中,这些研究人员将3月份逐渐增加的公共生活限制与COVID-19病例数的发展联系起来。特别是,他们研究了3月份的三套干预措施的影响:3月8日左右取消大型公共活动,3月16日关闭教育机构和许多商店,3月22日大范围的禁止接触。
为此,这些研究人员将COVID-19新感染的时间过程数据与流行病学动力学模型相结合,分析了迄今为止的疫情发展过程,并对未来的情景进行了研究。根据计算机模型,一揽子遏制措施最初减缓了COVID-19的传播速度,最终阻止了可怕的指数式增长。论文通讯作者、马克斯-普朗克动力学与自组织研究所小组负责人Viola Priesemann说,“我们的分析清楚地显示了各种干预措施的效果,这些干预措施最终共同导致了强烈的趋势逆转。因此,我们的模型计算向我们展示了与干预措施密切相关的人们行为变化的整体影响。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


