人血管活性肠肽受体1的结构与功能研究取得进展
来源:上海药物研究所 2020-08-18 19:11
8月17日,中国科学院上海药物研究所研究员蒋轶、徐华强团队联合浙江大学医学院研究员张岩团队,在人血管活性肠肽受体1(VIP1R)研究领域取得重要进展,首次解析了VIP1R与多肽配体PACAP27和Gs蛋白复合物的冷冻电镜结构。该研究论文在线发表于《自然-通讯》(Nature Communications)。人血管活性肠肽受体1(VIPR1R)是B
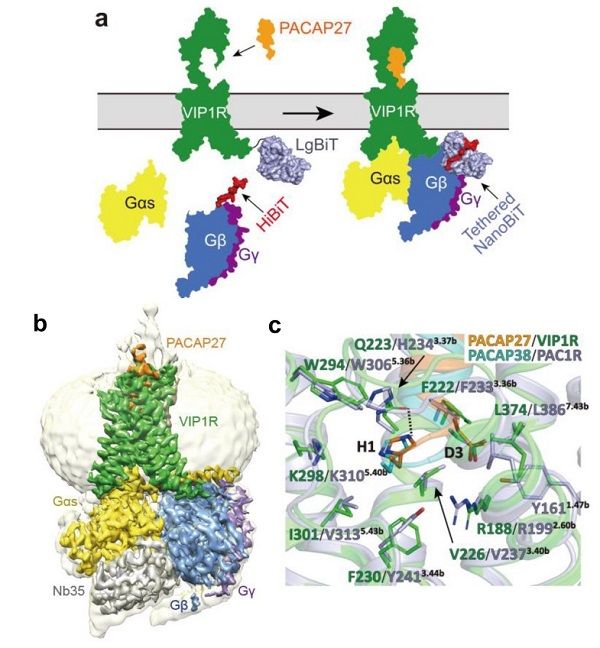
8月17日,中国科学院上海药物研究所研究员蒋轶、徐华强团队联合浙江大学医学院研究员张岩团队,在人血管活性肠肽受体1(VIP1R)研究领域取得重要进展,首次解析了VIP1R与多肽配体PACAP27和Gs蛋白复合物的冷冻电镜结构。该研究论文在线发表于《自然-通讯》(Nature Communications)。
人血管活性肠肽受体1(VIPR1R)是B类GPCR成员,广泛分布于中枢神经系统的大脑皮质和下丘脑。在生物体内,VIP1R在心脏节律、学习、记忆、焦虑以及机体对应激和脑损伤应答等方面发挥着重要调节作用。开发靶向VIP1R的多肽和小分子药物对睡眠紊乱、中风、神经退行性疾病以及和老龄化相关的记忆损伤等疾病的治疗具有积极作用。
VIP1R受体与下游Gs效应蛋白组装效率相对较低,导致复合物稳定性差和构象不均一等问题,为该受体复合物的结构解析带来了诸多技术难题。传统NanoBiT方法基于蛋白质构象互补的原理,利用大片段(LgBiT)和小片段(SmBiT)互补结合为完整且具有活性的荧光素酶,从而实现蛋白质间互作的检测。受到该系统启发,研究团队开创性地利用与LgBiT具有更强亲和力的SmBiT突变体HiBiT,通过分别将LgBiT和HiBiT与VIP1R和Gs蛋白连接,增加局部的复合物组分浓度,提高了复合物的组装效率和样品稳定性,最终获得了稳定的VIP1R复合物用于结构研究。
利用单颗粒冷冻电镜重构技术,研究人员首次解析了VIP1R结合PACAP27和Gs蛋白复合物的高分辨率结构。通过对比其他B类GPCR成员的多肽结合口袋,研究发现VIP1R具有相对较小的胞内多肽配体结合口袋,并进一步明确了PACAP27多肽结合VIP1R的结构细节,从结构和功能层面确证了多肽氨基末端残基对VIP1R结合和激活的关键作用;通过比对VIP1R的同亚家族受体垂体腺苷酸环化酶激活多肽受体I(PAC1R)与PACAP38复合物的结构,研究人员对PACAP配体识别该亚家族受体的特性进行了对比分析。相对PAC1R,内源性配体VIP对VIP1R显示出更高的选择性,研究也对该VIP的受体选择性提供了潜在的结构学解释;最后,研究人员阐明了VIP1R受体激活和G蛋白偶联的机制,以及该机制相较其他B类GPCR成员的异同等。该项研究为理解多肽受体识别并激活VIP1R的分子机制提供了结构基础,拓展了对整个B类GPCR家族配体识别和信号转导机理的认识,也为以VIP1R为靶点的多肽和小分子药物开发提供了结构模型。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


