华北制药**重组人源抗狂犬病毒单抗上市申请拟纳入优先审评
来源:药明康德 2020-08-06 07:41
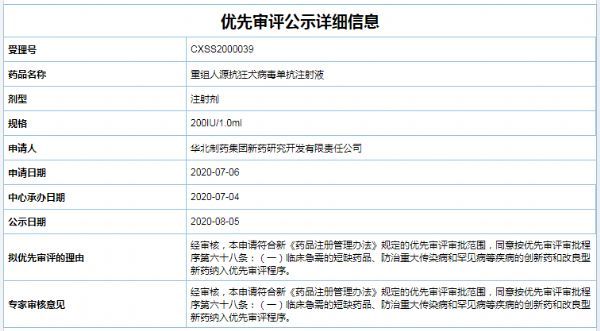
中国国家药监局(NMPA)药品审评中心网站信息显示,华北制药的重组人源抗狂犬病毒单抗注射液上市申请已于8月5日被纳入拟优先审评名单,理由是“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”。重组人源抗狂犬病毒单抗注射液申请上市的适应症是与人用狂犬病疫苗联用,用以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动
中国国家药监局(NMPA)药品审评中心网站信息显示,华北制药的重组人源抗狂犬病毒单抗注射液上市申请已于8月5日被纳入拟优先审评名单,理由是“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”。重组人源抗狂犬病毒单抗注射液申请上市的适应症是与人用狂犬病疫苗联用,用以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其它狂犬病毒易感动物咬伤、抓伤患者的被动免疫。
重组人源抗狂犬病毒单抗注射液(rhRIG)是华北制药自主创新项目, 被列为国家“重大新药创制”科技重大专项品种。2007年6月28日华北制药首次提交该药临床试验申请(200IU/瓶,500 IU/瓶两个规格),并于2009年6月25日获得临床试验批件(批件号为2009L06541和2009L06542),该项目Ⅰ期临床试验于2013年10月完成,Ⅱ期临床试验于2018年4月完成。试验结果显示,rhRIG与疫苗联用起效更快,中和作用更高,整体保护效力优于HRIG与疫苗联用;受试者总体耐受性好,无因不良反应而退出试验的受试者。
2020年4月,华北制药宣布完成III期临床试验并取得III期临床试验报告,经过专家最终审核确认后,该临床试验报告结论为:重组人源抗狂犬病毒单抗注射液(rhRIG)联合人用狂犬病疫苗对III级疑似狂犬病毒暴露人群的暴露后预防达到主要疗效和次要疗效终点,且安全性良好,达到方案设定目标,试验药物重组人源抗狂犬病毒单抗注射液(rhRIG)是安全、有效的;试验结果显示,重组人源抗狂犬病毒单抗注射液(rhRIG)联合狂犬病疫苗和狂犬病人免疫球蛋白(HRIG)联合狂犬病疫苗在Ⅲ级疑似狂犬病毒暴露人群中注射后第7天狂犬病毒中和抗体几何平均浓度(GMC)比较结果显示,重组人源抗狂犬病毒单抗注射液(rhRIG)联合狂犬病疫苗非劣效于狂犬病人免疫球蛋白(HRIG)联合狂犬病疫苗。据华北制药公告称,目前,国内尚无重组抗狂犬病毒单抗药物上市销售。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->