2020年7月Science期刊不得不看的亮点研究
来源:本站原创 2020-07-31 22:05
2020年7月31日讯/生物谷BIOON/---2020年7月份即将结束了,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:重磅!分子伴侣介导的自噬调节胚胎干细胞的多能性,有望开发新的再生疗法doi:10.1126/science.abb4467; doi:10.1126/science.abd1431
2020年7月31日讯/生物谷BIOON/---2020年7月份即将结束了,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:重磅!分子伴侣介导的自噬调节胚胎干细胞的多能性,有望开发新的再生疗法
doi:10.1126/science.abb4467; doi:10.1126/science.abd1431
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现胚胎干细胞中称为CMA(chaperone-mediated autophagy, 分子伴侣介导的自噬)的自噬过程可能作为修复或再生受损细胞和器官的新型治疗靶点。相关研究结果发表在2020年7月24日的Science 期刊上,论文标题为“Chaperone-mediated autophagy regulates the pluripotency of embryonic stem cells”。

这项新的临床前研究首次展示了胚胎干细胞如何将CMA保持在低水平,以促进这种自我更新,而且我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法来关闭这种抑制,以增强CMA活性和让它们分化成特化细胞。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院癌症生物学教授Xiaolu Yang博士说,“对于希望开发组织或器官再生疗法的人们来说,这是干细胞生物学领域的一个耐人寻味的发现。我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法:CMA和一种由CMA调节的 称为α-酮戊二酸(alpha-ketoglutarate)的代谢物。合理干预或引导这些功能可能是提高再生医学方法效率的有力途径。”
2.Science:重大进展!揭示肿瘤起始细胞通过IL-33/TGF-β壁龛信号循环促进肿瘤进展
doi:10.1126/science.aay1813
一小部分具有长期致瘤能力的肿瘤细胞,即肿瘤起始细胞(tumor-initiating cell, TIC),在癌症的发展和治疗抵抗性中起着关键作用。然而,由于缺乏对TIC脆弱性的识别,有效的TIC靶向疗法的开发进展受限。正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其后代的恶性表型(malignant phenotype)受到来自TIC相关肿瘤微环境(即所谓的TIC壁龛)的各种因素控制。因此,从机制上理解TIC和TIC壁龛(TIC niche)之间的相互作用,可以加速持久性癌症治疗药物的开发。
利用鳞状细胞癌(SCC)的小鼠模型,来自美国俄勒冈健康与科学大学的研究人员之前已发现转化生长因子β(TGF-β)可诱导一部分耐药的TIC出现,从而产生浸润性、分化不良的后代。他们观察到,这些TGF-β反应性的肿瘤细胞在空间上与邻近基质中的局部TGF-β表达相关。因此,导致“富含TGF-β”的肿瘤微环境的机制可能是TIC-TIC壁龛相互作用出现的基础,并有可能被用来作为破坏TIC稳定的新靶点。
鉴于正常干细胞通过发送短距离信号来协调它们的壁龛,这些研究人员假设TIC可能会向邻近基质发送特定的信号分子,以诱导TIC支持性壁龛。在一项新的研究中,通过着重关注TGF-β反应性TIC附近的细胞因子环境(cytokine milieu)和免疫细胞,这些研究人员确定了TIC如何产生一种空间上独特的壁龛微环境,这是SCC的浸润性进展和耐药性所必需的。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression”。
在寻找邻近肿瘤微环境的潜在旁分泌调节剂时,他们发现白细胞介素-33(IL-33)是TGF-β反应性TIC中上调最高的细胞因子。鉴于IL-33在正常情况下储存在细胞核中,他们发现它在NRF2介导的抗氧化反应中被释放到细胞外空间,这是TGF-β反应性TIC的标志。这种源自TIC的IL-33是SCC的浸润性进展和耐药性所必需的。
从机制上讲,IL-33诱导一部分表达IL-33受体ST2和高亲和力IgE受体(FcεRIα)的肿瘤相关巨噬细胞亚群在接近TIC的地方(即半径50μm内)堆积。这些以前未被重视的FcεRIα+巨噬细胞从骨髓源细胞中分化并交替激活,通过IL-33-ST2-NF-κB通路构建出一种富含TGF-β的壁龛微环境,从而诱导TGF-β信号旁分泌到TIC,并进一步上调IL-33的表达。阻断该通路或清除FcεRIα+巨噬细胞,都可减少TGF-β反应性TIC数量,降低浸润性肿瘤进展速度和化疗耐药性。
治疗抵抗性的TIC被认为是癌症治疗失败的主要元凶。通过研究小鼠模型,这些研究人员揭示了TIC壁龛形成的细胞和分子基础,其中TIC壁龛促进SCC恶性进展和出现耐药性。他们发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环,这为自我强化TIC-TIC壁龛相互作用提供了机制上的新见解。这种相互作用可能是破坏TIC稳定以提高癌症治疗效果的潜在靶标。
3.Science:人类胎儿早期不完全的B细胞耐受性有利于多反应性B细胞的积累
doi:10.1126/science.aay9733
广泛的免疫球蛋白基因重排使得人类能够识别多种潜在病原体。这种抗体库(antibody repertoire,也译为抗体谱)在早期生命期间受到更多的限制,以防止自体反应性B细胞的产生,毕竟耐受性似乎并不完全。此外,新生儿血清中含有丰富的自身抗体,这也提示着妊娠期B细胞耐受性尚未完全建立。
B细胞是我们适应性免疫系统的主要支柱。它们在骨髓中发育,随后在血液中循环。B细胞负责产生针对侵入性病原体(所谓的抗原)的抗体。每个B细胞对一种抗原具有高度特异性。抗体是较大的称为免疫球蛋白的蛋白分子,分泌到血液中。它们也以膜结合的形式产生,存在于B细胞表面上,因此被称为B细胞受体(BCR)。
在一项新的研究中,来自美国耶鲁大学和罗彻斯特大学的研究人员评估了从人类胎儿肝脏、骨髓和脾脏的B细胞中克隆的450多种抗体的反应性。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Autoreactivity in naïve human fetal B cells is associated with commensal bacteria recognition”。
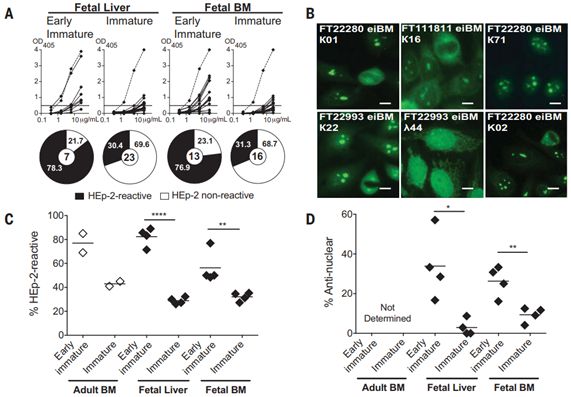
他们发现人类胎儿早期不完全的B细胞耐受性有利于多反应性B细胞的积累,在没有任何体细胞高频突变(somatic hypermutation)的情况下,这些B细胞可结合来自健康成年人的凋亡细胞和共生菌。这些反应性B细胞在接触细菌之前就已产生,这可能会促进以后有益的共生菌-宿主相互作用和/或在生命的第一周增强宿主的防御。
因此,受限的胎儿免疫前抗体库含有潜在有益的自反应性先天性B细胞特异性,可能有利于在发育过程中清除凋亡细胞,并在出生后促进肠道微生物群的形成。
4.Science:揭秘转移性癌症如何在不利的蛛网膜下腔环境中不断进展?
doi:10.1126/science.aaz2193; doi:10.1126/science.abb7041
近日,一项刊登在国际杂志Science上的研究报告中,来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究揭示了转移性癌症如何在不利的蛛网膜下腔(subarachnoid space)环境中生存,文章中,研究人员描述了如何利用RNA测序研究对柔脑膜转移(LS,leptomeningeal metastases)患者进行研究,LS是一种涉及脊髓膜和脑膜的癌症类型。
这项研究中,研究人员重点对中枢神经系统中一种名为柔脑膜转移(LS)的特殊类型癌症进行研究,他们想要阐明为何特定类型的癌症不仅会出现在蛛网膜下腔中,而且还能在这种不利的环境中生存并发生转移,蛛网膜下腔是充满脑脊液的中枢神经系统中分离的部位。
研究者首先从5名柔脑膜转移患者的机体中收集脑脊髓液样本,随后对这些样本进行单细胞RNA测序分析,结果发现,癌细胞或许拥有一种高亲和力的铁收集系统,其能帮助癌细胞利用脑脊髓液中发现的铁离子,研究者表示,脑脊液中几乎没有铁离子,这就使其能够成为对于DNA合成和细胞代谢非常重要的珍贵“商品”;而利用这种铁离子收集系统就能帮助癌细胞比巨噬细胞表现得更好,从而就能癌细胞占据上风,最终这种铁离子捕获不仅会促进癌细胞存活,而且还能帮助癌症不断进展。后期研究人员还将继续深入研究基于本文研究结果开发出更多治疗转移性癌症的新型靶向性疗法。
5.Science全文编译!我国科学家从结构上揭示一种强效的治疗性抗体中和SARS-CoV-2和SARS-CoV机制
doi:10.1126/science.abc5881
据世界卫生组织(WHO)统计,截至2020年6月8日,2019年冠状病毒病(COVID-19)大流行已导致200多个国家/地区的700多万感染,并造成40万人死亡。导致这次大流行的病原体是一种新出现的冠状病毒:SARS-CoV-2,它与密切相关的SARS-CoV同属于冠状病毒科β冠状病 毒属B谱系。位于SARS-CoV-2和SARS-CoV包膜的刺突糖蛋白(S)具有大约80%的氨基酸序列一致性,而且这两种病毒均利用人血管紧张素转化酶2(hACE2)进入宿主细胞。细胞进入是通过S蛋白同源三聚体介导的病毒-受体结合实现的,然后是病毒-宿主膜融合,其中这种 结合是通过S蛋白的受体结合结构域(RBD)进行的。破坏S蛋白在感染建立中所发挥的这一关键作用是中和抗体的主要目标,也是治疗性干预和疫苗设计的重点。
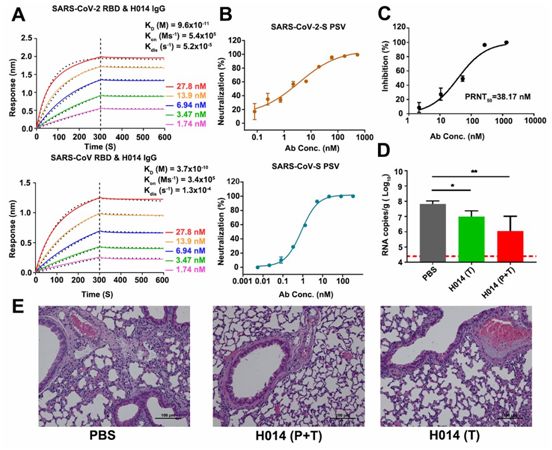
SARS-CoV和SARS-CoV-2的RBD具有大约75%的氨基酸序列一致性,因此有可能发现靶向RBD的交叉中和抗体。在一项新的研究中,来自中国科学院、中国科学院大学、中国军事医学科学院、中国食品药品检定研究院、中国医学科学院、北京协和医学院、北京神州细胞生物技 术公司和北京义翘神州科技公司的研究人员通过使用噬菌体展示技术,构建出一个抗体库,该抗体库是从由用重组SARS-CoV RBD免疫的小鼠的外周淋巴细胞中提取的RNA产生的。利用SARS-CoV-2 RBD作为筛选噬菌体抗体库的靶点,寻找潜在的命中目标。将显示与SARS- CoV-2 RBD紧密结合的抗体作为嵌合抗体进行进一步优化,并使用基于水泡性口炎病毒(VSV)的假型病毒系统测试它们的中和活性。相关研究结果于2020年7月23日在线发表在Science期刊上,论文标题为“Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody”。
6.Science:科学家发现机体衰老的两种途径 并为有效促进机体长寿提供了新见解
doi:10.1126/science.aax9552
日前,一项刊登在国际杂志Science上题为“A programmable fate decision landscape underlies single-cell aging in yeast”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究解开了机体衰老之谜背后的关键机制,文章中,研究人员发现了在衰老过程细胞游历的两种不同路径,同时设计出了一种新方法来对这些过程进行遗传编程从而延长机体的寿命。
我们人类的寿命是由机体细胞的衰老所决定的,为了理解是否不同的细胞是否会以相同的速度和相同的原因老化,研究人员对酿酒酵母的老化进行了研究,酿酒酵母是一种用于研究衰老(包括皮肤和干细胞的衰老途径)机制的可操控的模型。研究者发现,携带相同遗传物质并处于相同环境中中的细胞会以截然不同的方式来衰老,而其命运也会通过不同的分子和细胞轨迹进行展开,利用微流体、计算机模型和其它技术进行研究后,研究者发现,大约一半的细胞会随着细胞核核仁的稳定性下降而衰老,核仁是细胞核DNA的一个特殊区域,在其中会合成产生蛋白质工厂的关键组分,相比之下,另外一半的细胞老化则是由于线粒体的功能障碍所致。
在机体生命早期,细胞便踏上了核仁或线粒体的途径,并能在整个生命周期中通过衰老和死亡来遵循这一机体衰老的途径,在控制中心中,研究人员发现了一种引导这些衰老过程的主要回路,研究者Nan Hao说道,为了理解细胞是如何做出决定的,研究人员识别出了机体每种衰老途径背后的分子过程以及这些衰老途径之间的关联,最终揭示了一种控制细胞衰老的分子回路,这就类似于控制家用电器的电路一样。
随后研究人员通过联合研究开发出了一种新的衰老景观模型,这样他们就能操控并最终优化这种老化模型,计算机模拟技术则能够帮助研究者通过修复DNA的方式来重编程主要的分子回路,并能开发出一种以显著延长机体寿命为主要特征的老化途径。本文研究中,研究人员提出了合理设计基因或基于化学的疗法来重编程人类细胞衰老的可能性,其目标在于选择性地减缓人类的衰老并延长人类的寿命。
7.Science:构建出更稳定的SARS-CoV-2刺突蛋白,有助加快COVID-19疫苗开发
doi:10.1126/science.abd0826
针对快速开发数十亿剂救命的COVID-19疫苗的需求,来自美国德克萨斯大学奥斯汀分校的研究人员在一项新的研究中成功地重新设计了新型冠状病毒SARS-CoV-2的一种关键蛋白,这种改造可以使得全世界更快更稳定地生产疫苗。相关研究结果于2020年7月23日在线发表在 Science期刊上,论文标题为“Structure-based design of prefusion-stabilized SARS-CoV-2 spikes”。论文通讯作者为德克萨斯大学奥斯汀分校分子生物科学系副教授Jason McLellan、德克萨斯大学奥斯汀分校分子生物科学系副教授Ilya Finkelstein和德克萨斯大 学奥斯汀分校化学工程系教授Jennifer A. Maynard。论文第一作者为McLellan实验室博士后研究员Ching-Lin Hsieh。

大多数冠状病毒候选疫苗都会训练人类免疫系统识别SARS-CoV-2病毒表面的一种关键蛋白,即刺突蛋白(S),以对抗感染。这些作者设计了这种蛋白的一种新版本,当在细胞中表达时,它产生的蛋白数量是早前已在多种COVID-19疫苗中使用的合成刺突蛋白的10倍。他们 还与美国国家卫生研究院的同事们一起设计了在目前进入美国临床试验的至少两种COVID-19候选疫苗中发现的早期版本的刺突蛋白。
这种称为HexaPro的新蛋白版本也比这些研究人员早期开发的刺突蛋白版本更稳定,这应该使得它更容易存储和运输。即使在热应激下、在室温下储存期间和经过多次冻融,它也能保持其形状。这些特性是一种强效的疫苗所需要的。
8.Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
doi:10.1126/science.abb1400
近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你智能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
9.Science:在胚胎发生期间,细胞间接触区域决定着细胞命运
doi:10.1126/science.aar5663
作为一类海洋无脊椎动物,海鞘动物(Ascidians)显示了一种极端形式的胚胎可重复性:在单个胚胎中可以发现同源细胞,早期的胚胎细胞谱系被认为是不变的。胚胎的几何形状甚至在4亿年前分歧开的物种之间也是保守的,尽管它们的基因组非常不同。由于早期胚胎 发育的进化保守性和缓冲遗传趋异的能力,海鞘成为研究细胞可重复性机制的一种有吸引力的模型系统。
在一项新的研究中,为了定量确定海鞘动物Phallusia mammillata的胚胎重现性,来自法国、美国和德国的研究人员首先建立了一个高分辨率的胚胎细胞谱系、细胞形状和细胞相互作用的图谱。他们利用多视角光片显微镜每2分钟对10个活胚胎进行成像,直到神经胚期( neurula stage)结束。相关研究结果发表在2020年7月10日的Science期刊上,论文标题为“Contact area–dependent cell communication and the morphological invariance of ascidian embryogenesis”。

为了系统地测量一系列的细胞时间和空间特征的发育变化,他们开发了一个强大的、可扩展的自适应分割和跟踪胚胎细胞程序(ASTEC),它与高通量多视角光片成像数据集兼容。他们将这些特征与细胞命运决定相关联,而细胞命运决定在海鞘动物中主要是由差异性的姐 妹细胞诱导控制的。受之前研究工作---表明信号细胞(signaling cell)的接触区域控制着海鞘的神经诱导---的启发,他们将他们的几何结构描述与信号基因表达图谱整合在一起。这种整合使得他们能够通过计算和实验方法测试一个假设:接触面积依赖性的细胞通信 对胚胎几何结构产生限制。
这些研究人员发现,一直到神经胚期,Phallusia mammillata胚胎发育时没有细胞生长、程序性细胞死亡或相邻细胞交换。除了细胞位置、细胞周期持续时间和细胞谱系之外,他们还观察到细胞排列的高度重现性。在所有10个研究的胚胎中,75%的细胞至少共享了80%的 相邻细胞。此外,同源细胞之间的接触区域在不同胚胎中的变化不到20%。在机制上,他们发现了细胞排列控制和不对称细胞分裂之间存在紧密联系,不对称细胞分裂会产生不同命运的姐妹细胞。
10.Science:亨廷顿舞蹈病改变人类神经发育
doi:10.1126/science.aax3338
亨廷顿舞蹈病(Huntington's disease, HD)是已被最广泛研究的四种主要神经退行性疾病之一。这种疾病是由亨廷顿蛋白(huntingtin, HTT)编码基因发生突变引起的。患有HD的人会经历沮丧、易怒以及其他神经系统和行为问题。他们也可能在处理信息和控制身体动作方面有困难。
虽然HD是一种晚期表现的神经退行性疾病,但小鼠研究和对症状前突变携带者的神经影像学研究都表明,这种疾病可能会影响神经发育。为了确定是否真的如此,在一项新的研究中,来自法国的研究人员研究了来自携带HD突变的人类胎儿(妊娠13周)的组织。相关研究结果于2020年7月16日在线发表在Science期刊上,论文标题为“Huntington’s disease alters human neurodevelopment”。
这些组织在发育中的皮层内表现出明显的异常,包括突变的HTT蛋白和连接复合体(junctional complex)蛋白的错误定位,神经前体细胞(neuroprogenitor cell)极性和分化的缺陷,异常的纤毛发生,以及有丝分裂和细胞周期进程的变化。(生物谷 Bioon.com)
1.Science:重磅!分子伴侣介导的自噬调节胚胎干细胞的多能性,有望开发新的再生疗法
doi:10.1126/science.abb4467; doi:10.1126/science.abd1431
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现胚胎干细胞中称为CMA(chaperone-mediated autophagy, 分子伴侣介导的自噬)的自噬过程可能作为修复或再生受损细胞和器官的新型治疗靶点。相关研究结果发表在2020年7月24日的Science 期刊上,论文标题为“Chaperone-mediated autophagy regulates the pluripotency of embryonic stem cells”。

图片来自CC0 Public Domain。
这项新的临床前研究首次展示了胚胎干细胞如何将CMA保持在低水平,以促进这种自我更新,而且我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法来关闭这种抑制,以增强CMA活性和让它们分化成特化细胞。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院癌症生物学教授Xiaolu Yang博士说,“对于希望开发组织或器官再生疗法的人们来说,这是干细胞生物学领域的一个耐人寻味的发现。我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法:CMA和一种由CMA调节的 称为α-酮戊二酸(alpha-ketoglutarate)的代谢物。合理干预或引导这些功能可能是提高再生医学方法效率的有力途径。”
2.Science:重大进展!揭示肿瘤起始细胞通过IL-33/TGF-β壁龛信号循环促进肿瘤进展
doi:10.1126/science.aay1813
一小部分具有长期致瘤能力的肿瘤细胞,即肿瘤起始细胞(tumor-initiating cell, TIC),在癌症的发展和治疗抵抗性中起着关键作用。然而,由于缺乏对TIC脆弱性的识别,有效的TIC靶向疗法的开发进展受限。正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其后代的恶性表型(malignant phenotype)受到来自TIC相关肿瘤微环境(即所谓的TIC壁龛)的各种因素控制。因此,从机制上理解TIC和TIC壁龛(TIC niche)之间的相互作用,可以加速持久性癌症治疗药物的开发。
利用鳞状细胞癌(SCC)的小鼠模型,来自美国俄勒冈健康与科学大学的研究人员之前已发现转化生长因子β(TGF-β)可诱导一部分耐药的TIC出现,从而产生浸润性、分化不良的后代。他们观察到,这些TGF-β反应性的肿瘤细胞在空间上与邻近基质中的局部TGF-β表达相关。因此,导致“富含TGF-β”的肿瘤微环境的机制可能是TIC-TIC壁龛相互作用出现的基础,并有可能被用来作为破坏TIC稳定的新靶点。
鉴于正常干细胞通过发送短距离信号来协调它们的壁龛,这些研究人员假设TIC可能会向邻近基质发送特定的信号分子,以诱导TIC支持性壁龛。在一项新的研究中,通过着重关注TGF-β反应性TIC附近的细胞因子环境(cytokine milieu)和免疫细胞,这些研究人员确定了TIC如何产生一种空间上独特的壁龛微环境,这是SCC的浸润性进展和耐药性所必需的。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Tumor-initiating cells establish an IL-33–TGF-β niche signaling loop to promote cancer progression”。
在寻找邻近肿瘤微环境的潜在旁分泌调节剂时,他们发现白细胞介素-33(IL-33)是TGF-β反应性TIC中上调最高的细胞因子。鉴于IL-33在正常情况下储存在细胞核中,他们发现它在NRF2介导的抗氧化反应中被释放到细胞外空间,这是TGF-β反应性TIC的标志。这种源自TIC的IL-33是SCC的浸润性进展和耐药性所必需的。
从机制上讲,IL-33诱导一部分表达IL-33受体ST2和高亲和力IgE受体(FcεRIα)的肿瘤相关巨噬细胞亚群在接近TIC的地方(即半径50μm内)堆积。这些以前未被重视的FcεRIα+巨噬细胞从骨髓源细胞中分化并交替激活,通过IL-33-ST2-NF-κB通路构建出一种富含TGF-β的壁龛微环境,从而诱导TGF-β信号旁分泌到TIC,并进一步上调IL-33的表达。阻断该通路或清除FcεRIα+巨噬细胞,都可减少TGF-β反应性TIC数量,降低浸润性肿瘤进展速度和化疗耐药性。
治疗抵抗性的TIC被认为是癌症治疗失败的主要元凶。通过研究小鼠模型,这些研究人员揭示了TIC壁龛形成的细胞和分子基础,其中TIC壁龛促进SCC恶性进展和出现耐药性。他们发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环,这为自我强化TIC-TIC壁龛相互作用提供了机制上的新见解。这种相互作用可能是破坏TIC稳定以提高癌症治疗效果的潜在靶标。
3.Science:人类胎儿早期不完全的B细胞耐受性有利于多反应性B细胞的积累
doi:10.1126/science.aay9733
广泛的免疫球蛋白基因重排使得人类能够识别多种潜在病原体。这种抗体库(antibody repertoire,也译为抗体谱)在早期生命期间受到更多的限制,以防止自体反应性B细胞的产生,毕竟耐受性似乎并不完全。此外,新生儿血清中含有丰富的自身抗体,这也提示着妊娠期B细胞耐受性尚未完全建立。
B细胞是我们适应性免疫系统的主要支柱。它们在骨髓中发育,随后在血液中循环。B细胞负责产生针对侵入性病原体(所谓的抗原)的抗体。每个B细胞对一种抗原具有高度特异性。抗体是较大的称为免疫球蛋白的蛋白分子,分泌到血液中。它们也以膜结合的形式产生,存在于B细胞表面上,因此被称为B细胞受体(BCR)。
在一项新的研究中,来自美国耶鲁大学和罗彻斯特大学的研究人员评估了从人类胎儿肝脏、骨髓和脾脏的B细胞中克隆的450多种抗体的反应性。相关研究结果发表在2020年7月17日的Science期刊上,论文标题为“Autoreactivity in naïve human fetal B cells is associated with commensal bacteria recognition”。

图片来自Science, 2020, doi:10.1126/science.aay9733。
他们发现人类胎儿早期不完全的B细胞耐受性有利于多反应性B细胞的积累,在没有任何体细胞高频突变(somatic hypermutation)的情况下,这些B细胞可结合来自健康成年人的凋亡细胞和共生菌。这些反应性B细胞在接触细菌之前就已产生,这可能会促进以后有益的共生菌-宿主相互作用和/或在生命的第一周增强宿主的防御。
因此,受限的胎儿免疫前抗体库含有潜在有益的自反应性先天性B细胞特异性,可能有利于在发育过程中清除凋亡细胞,并在出生后促进肠道微生物群的形成。
4.Science:揭秘转移性癌症如何在不利的蛛网膜下腔环境中不断进展?
doi:10.1126/science.aaz2193; doi:10.1126/science.abb7041
近日,一项刊登在国际杂志Science上的研究报告中,来自纪念斯隆凯特琳癌症中心等机构的科学家们通过研究揭示了转移性癌症如何在不利的蛛网膜下腔(subarachnoid space)环境中生存,文章中,研究人员描述了如何利用RNA测序研究对柔脑膜转移(LS,leptomeningeal metastases)患者进行研究,LS是一种涉及脊髓膜和脑膜的癌症类型。
这项研究中,研究人员重点对中枢神经系统中一种名为柔脑膜转移(LS)的特殊类型癌症进行研究,他们想要阐明为何特定类型的癌症不仅会出现在蛛网膜下腔中,而且还能在这种不利的环境中生存并发生转移,蛛网膜下腔是充满脑脊液的中枢神经系统中分离的部位。
研究者首先从5名柔脑膜转移患者的机体中收集脑脊髓液样本,随后对这些样本进行单细胞RNA测序分析,结果发现,癌细胞或许拥有一种高亲和力的铁收集系统,其能帮助癌细胞利用脑脊髓液中发现的铁离子,研究者表示,脑脊液中几乎没有铁离子,这就使其能够成为对于DNA合成和细胞代谢非常重要的珍贵“商品”;而利用这种铁离子收集系统就能帮助癌细胞比巨噬细胞表现得更好,从而就能癌细胞占据上风,最终这种铁离子捕获不仅会促进癌细胞存活,而且还能帮助癌症不断进展。后期研究人员还将继续深入研究基于本文研究结果开发出更多治疗转移性癌症的新型靶向性疗法。
5.Science全文编译!我国科学家从结构上揭示一种强效的治疗性抗体中和SARS-CoV-2和SARS-CoV机制
doi:10.1126/science.abc5881
据世界卫生组织(WHO)统计,截至2020年6月8日,2019年冠状病毒病(COVID-19)大流行已导致200多个国家/地区的700多万感染,并造成40万人死亡。导致这次大流行的病原体是一种新出现的冠状病毒:SARS-CoV-2,它与密切相关的SARS-CoV同属于冠状病毒科β冠状病 毒属B谱系。位于SARS-CoV-2和SARS-CoV包膜的刺突糖蛋白(S)具有大约80%的氨基酸序列一致性,而且这两种病毒均利用人血管紧张素转化酶2(hACE2)进入宿主细胞。细胞进入是通过S蛋白同源三聚体介导的病毒-受体结合实现的,然后是病毒-宿主膜融合,其中这种 结合是通过S蛋白的受体结合结构域(RBD)进行的。破坏S蛋白在感染建立中所发挥的这一关键作用是中和抗体的主要目标,也是治疗性干预和疫苗设计的重点。

H014是一种具有治疗价值的B谱系冠状病毒交叉中和抗体,图片来自Science, 2020, doi:10.1126/science.abc5881。
SARS-CoV和SARS-CoV-2的RBD具有大约75%的氨基酸序列一致性,因此有可能发现靶向RBD的交叉中和抗体。在一项新的研究中,来自中国科学院、中国科学院大学、中国军事医学科学院、中国食品药品检定研究院、中国医学科学院、北京协和医学院、北京神州细胞生物技 术公司和北京义翘神州科技公司的研究人员通过使用噬菌体展示技术,构建出一个抗体库,该抗体库是从由用重组SARS-CoV RBD免疫的小鼠的外周淋巴细胞中提取的RNA产生的。利用SARS-CoV-2 RBD作为筛选噬菌体抗体库的靶点,寻找潜在的命中目标。将显示与SARS- CoV-2 RBD紧密结合的抗体作为嵌合抗体进行进一步优化,并使用基于水泡性口炎病毒(VSV)的假型病毒系统测试它们的中和活性。相关研究结果于2020年7月23日在线发表在Science期刊上,论文标题为“Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody”。
6.Science:科学家发现机体衰老的两种途径 并为有效促进机体长寿提供了新见解
doi:10.1126/science.aax9552
日前,一项刊登在国际杂志Science上题为“A programmable fate decision landscape underlies single-cell aging in yeast”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究解开了机体衰老之谜背后的关键机制,文章中,研究人员发现了在衰老过程细胞游历的两种不同路径,同时设计出了一种新方法来对这些过程进行遗传编程从而延长机体的寿命。
我们人类的寿命是由机体细胞的衰老所决定的,为了理解是否不同的细胞是否会以相同的速度和相同的原因老化,研究人员对酿酒酵母的老化进行了研究,酿酒酵母是一种用于研究衰老(包括皮肤和干细胞的衰老途径)机制的可操控的模型。研究者发现,携带相同遗传物质并处于相同环境中中的细胞会以截然不同的方式来衰老,而其命运也会通过不同的分子和细胞轨迹进行展开,利用微流体、计算机模型和其它技术进行研究后,研究者发现,大约一半的细胞会随着细胞核核仁的稳定性下降而衰老,核仁是细胞核DNA的一个特殊区域,在其中会合成产生蛋白质工厂的关键组分,相比之下,另外一半的细胞老化则是由于线粒体的功能障碍所致。
在机体生命早期,细胞便踏上了核仁或线粒体的途径,并能在整个生命周期中通过衰老和死亡来遵循这一机体衰老的途径,在控制中心中,研究人员发现了一种引导这些衰老过程的主要回路,研究者Nan Hao说道,为了理解细胞是如何做出决定的,研究人员识别出了机体每种衰老途径背后的分子过程以及这些衰老途径之间的关联,最终揭示了一种控制细胞衰老的分子回路,这就类似于控制家用电器的电路一样。
随后研究人员通过联合研究开发出了一种新的衰老景观模型,这样他们就能操控并最终优化这种老化模型,计算机模拟技术则能够帮助研究者通过修复DNA的方式来重编程主要的分子回路,并能开发出一种以显著延长机体寿命为主要特征的老化途径。本文研究中,研究人员提出了合理设计基因或基于化学的疗法来重编程人类细胞衰老的可能性,其目标在于选择性地减缓人类的衰老并延长人类的寿命。
7.Science:构建出更稳定的SARS-CoV-2刺突蛋白,有助加快COVID-19疫苗开发
doi:10.1126/science.abd0826
针对快速开发数十亿剂救命的COVID-19疫苗的需求,来自美国德克萨斯大学奥斯汀分校的研究人员在一项新的研究中成功地重新设计了新型冠状病毒SARS-CoV-2的一种关键蛋白,这种改造可以使得全世界更快更稳定地生产疫苗。相关研究结果于2020年7月23日在线发表在 Science期刊上,论文标题为“Structure-based design of prefusion-stabilized SARS-CoV-2 spikes”。论文通讯作者为德克萨斯大学奥斯汀分校分子生物科学系副教授Jason McLellan、德克萨斯大学奥斯汀分校分子生物科学系副教授Ilya Finkelstein和德克萨斯大 学奥斯汀分校化学工程系教授Jennifer A. Maynard。论文第一作者为McLellan实验室博士后研究员Ching-Lin Hsieh。

图片来自Science, 2020, doi:10.1126/science.abd0826。
大多数冠状病毒候选疫苗都会训练人类免疫系统识别SARS-CoV-2病毒表面的一种关键蛋白,即刺突蛋白(S),以对抗感染。这些作者设计了这种蛋白的一种新版本,当在细胞中表达时,它产生的蛋白数量是早前已在多种COVID-19疫苗中使用的合成刺突蛋白的10倍。他们 还与美国国家卫生研究院的同事们一起设计了在目前进入美国临床试验的至少两种COVID-19候选疫苗中发现的早期版本的刺突蛋白。
这种称为HexaPro的新蛋白版本也比这些研究人员早期开发的刺突蛋白版本更稳定,这应该使得它更容易存储和运输。即使在热应激下、在室温下储存期间和经过多次冻融,它也能保持其形状。这些特性是一种强效的疫苗所需要的。
8.Science新发现!巨大噬菌体或拥有一种能进行理想基因编辑操作的迷你Cas蛋白—CasΦ蛋白!
doi:10.1126/science.abb1400
近日,一篇刊登在国际杂志Science上题为“CRISPR-CasΦ from huge phages is a hypercompact genome editor”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,巨大噬菌体(megaphages)或许拥有进行理想基因编辑的mini-Cas蛋白。
CRISPR-Cas9和其相关的基因编辑工具的核心DNA切割蛋白最初来自于细菌,但最新发现的多种Cas蛋白显然是在感染细菌的病毒中进化而来的;新的Cas蛋白是在已知最大的感染细菌的病毒(噬菌体)中发现的,同时其也是迄今为止发现的最紧凑的工作Cas突变体,其只有Cas9蛋白尺寸的一半左右。更小、更为紧凑的Cas蛋白往往更容易被运送到细胞中进行基因编辑,因为其能被装入较小的运输载体中,目前最流行的一种运输载体就是腺相关病毒(AAV),超级紧凑的Cas蛋白也能在AAV内部为其它额外的“货物”留出空间,作为目前已知的最小的Cas蛋白,研究者新发现的CasΦ(Cas-phi)在被运输到细胞中来操纵作物基因或治疗人类疾病时,其要比当前的基因编辑工具更加具有优势。
研究者Patrick Pausch说道,腺病毒是运输基因载体完美的特洛伊木马,其能非常容易地对病毒进行编程并使其到达身体几乎任何部位,但你智能将一个很小的Cas9装入这样的病毒中来对其进行运输,如果有另外一种相比Cas9而言更为紧凑的CRISPR-Cas系统,那么就有足够的空间来容纳其它额外的元件,不同的蛋白质就会融合到Cas蛋白、DNA修复模板或其它能调节Cas蛋白并控制基因编辑结果的因子中。很显然,这些巨大噬菌体能利用CasΦ蛋白来诱骗细菌去抵御病毒,而不是自己。
9.Science:在胚胎发生期间,细胞间接触区域决定着细胞命运
doi:10.1126/science.aar5663
作为一类海洋无脊椎动物,海鞘动物(Ascidians)显示了一种极端形式的胚胎可重复性:在单个胚胎中可以发现同源细胞,早期的胚胎细胞谱系被认为是不变的。胚胎的几何形状甚至在4亿年前分歧开的物种之间也是保守的,尽管它们的基因组非常不同。由于早期胚胎 发育的进化保守性和缓冲遗传趋异的能力,海鞘成为研究细胞可重复性机制的一种有吸引力的模型系统。
在一项新的研究中,为了定量确定海鞘动物Phallusia mammillata的胚胎重现性,来自法国、美国和德国的研究人员首先建立了一个高分辨率的胚胎细胞谱系、细胞形状和细胞相互作用的图谱。他们利用多视角光片显微镜每2分钟对10个活胚胎进行成像,直到神经胚期( neurula stage)结束。相关研究结果发表在2020年7月10日的Science期刊上,论文标题为“Contact area–dependent cell communication and the morphological invariance of ascidian embryogenesis”。

图片来自Science, 2020, doi:10.1126/science.aar5663。
为了系统地测量一系列的细胞时间和空间特征的发育变化,他们开发了一个强大的、可扩展的自适应分割和跟踪胚胎细胞程序(ASTEC),它与高通量多视角光片成像数据集兼容。他们将这些特征与细胞命运决定相关联,而细胞命运决定在海鞘动物中主要是由差异性的姐 妹细胞诱导控制的。受之前研究工作---表明信号细胞(signaling cell)的接触区域控制着海鞘的神经诱导---的启发,他们将他们的几何结构描述与信号基因表达图谱整合在一起。这种整合使得他们能够通过计算和实验方法测试一个假设:接触面积依赖性的细胞通信 对胚胎几何结构产生限制。
这些研究人员发现,一直到神经胚期,Phallusia mammillata胚胎发育时没有细胞生长、程序性细胞死亡或相邻细胞交换。除了细胞位置、细胞周期持续时间和细胞谱系之外,他们还观察到细胞排列的高度重现性。在所有10个研究的胚胎中,75%的细胞至少共享了80%的 相邻细胞。此外,同源细胞之间的接触区域在不同胚胎中的变化不到20%。在机制上,他们发现了细胞排列控制和不对称细胞分裂之间存在紧密联系,不对称细胞分裂会产生不同命运的姐妹细胞。
10.Science:亨廷顿舞蹈病改变人类神经发育
doi:10.1126/science.aax3338
亨廷顿舞蹈病(Huntington's disease, HD)是已被最广泛研究的四种主要神经退行性疾病之一。这种疾病是由亨廷顿蛋白(huntingtin, HTT)编码基因发生突变引起的。患有HD的人会经历沮丧、易怒以及其他神经系统和行为问题。他们也可能在处理信息和控制身体动作方面有困难。
虽然HD是一种晚期表现的神经退行性疾病,但小鼠研究和对症状前突变携带者的神经影像学研究都表明,这种疾病可能会影响神经发育。为了确定是否真的如此,在一项新的研究中,来自法国的研究人员研究了来自携带HD突变的人类胎儿(妊娠13周)的组织。相关研究结果于2020年7月16日在线发表在Science期刊上,论文标题为“Huntington’s disease alters human neurodevelopment”。
这些组织在发育中的皮层内表现出明显的异常,包括突变的HTT蛋白和连接复合体(junctional complex)蛋白的错误定位,神经前体细胞(neuroprogenitor cell)极性和分化的缺陷,异常的纤毛发生,以及有丝分裂和细胞周期进程的变化。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


