肝癌一线治疗!因为罗氏,默沙东/卫材“免疫+靶向”组合Keytruda+Lenvima遭美国FDA拒绝批准!
来源:本站原创 2020-07-09 15:35
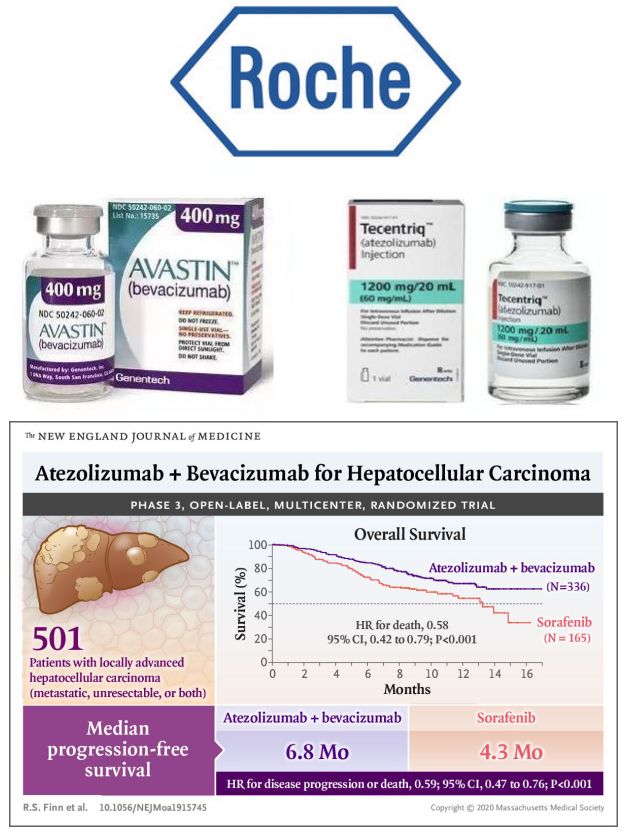
罗氏Tecentriq+Avastin(特善奇+安维汀)组合5月底获批,已证明总生存期益处!

2020年07月09日讯 /生物谷BIOON/ --默沙东(Merck & Co)与合作伙伴卫材(Eisai)近日联合宣布,美国食品和药物管理局(FDA)已针对双方各自的申请发布了一份完整回应函(CRL),该CRL涉及:将抗PD-1疗法Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗)与口服多受体酪氨酸激酶抑制剂Lenvima(乐卫玛,通用名:lenvatinib,仑伐替尼)联合用药,一线治疗不可切除性肝细胞癌(HCC)患者。
双方的申请基于单臂开放标签Ib期KEYNOTE-524/Study 116试验的数据。数据显示,在先前未接受过系统治疗的不可切除性HCC患者中,Keytruda+Lenvima治疗显示出有临床意义的疗效:总缓解率(ORR)为36%、中位缓解持续时间(DOR)为12.6个月。这些数据已于今年5月在2020年ASCO年会上公布,并支持FDA于2019年7月授予的突破性药物资格(BTD)。
然而,在默沙东和卫材申请的处方药用户收费法(PDUFA)生效日期之前,另一种联合疗法基于一项随机对照试验获得批准,该试验证明了总生存期(OS)益处。
根据检索生物谷文章,查明这里所指的另一种联合疗法是指罗氏(Roche)的抗PD-L1疗法Tecentriq(特善奇,通用名:atezolizumab,阿特珠单抗)与Avastin(安维汀,通用名:bevacizumab,贝伐单抗)组合疗法。该组合疗法于今年5月底获得美国FDA批准一线治疗HCC患者,具体为:先前未接受过系统治疗的不可切除性或转移性HCC患者。
值得一提的是,Tecentriq+Avastin组合是第一个也是唯一一个被批准用于治疗不可切除性或转移性HCC的癌症免疫治疗方案。来自III期IMbrave150研究的数据显示,与标准护理药物索拉非尼(sorafenib)相比,Tecentriq+Avastin联合治疗显著延长了总生存期(中位OS:不可估计 vs 13.2个月)和无进展生存期(中位PFS:6.8个月 vs 4.3个月)、将死亡风险降低42%、将疾病进展或死亡风险降低41%。
肝癌十年重大突破!Tecentriq+Avastin(特善奇+安维汀)一线治疗显著延长总生存期!
因此,FDA在CRL指出,默沙东和卫材的申请并没有提供证据:证明Keytruda+Lenvima联合治疗在先前未接受过系统疗法控制晚期疾病的不可切除性或转移性HCC治疗方面与目前可用的疗法(Tecentriq+Avastin)显示出有意义的优势。
由于基于KEYNOTE-524/Study-116研究的申请不再符合加速批准的标准,2家公司计划与FDA合作,采取适当的下一步措施,包括开展一项对照良好的临床试验,以证明联合用药的疗效和临床益处。目前,一项评估Keytruda+Lenvima组合疗法一线治疗晚期HCC的III期试验LEAP-002正在进行中,并已完成患者入组。
需要指出的是,此次CRL不影响Keytruda和Lenvima当前已批准的适应症。默沙东和卫材正在18项临床试验中继续对Keytruda+Lenvima联合治疗13种不同类型肿瘤进行评估,包括LEAP(LEnvatinib And Pembrolizumab)临床项目。

KEYNOTE-524/Study 116试验设计和数据:
KEYNOTE-524/Study 116(NCT03006926)是一项开放标签、单臂Ib期试验,在100例先前没有接受过系统治疗的不可切除性肝细胞癌(HCC)患者中开展,评估了Keytruda+Lenvima联合用药的疗效和安全性。研究中,患者接受每3周一次静脉输注200mg剂量Keytruda,同时每日一次口服Lenvima 8mg或12mg(根据基线体重:<60公斤,≥60公斤)。主要终点是独立影像学检查(IIR)根据改良实体瘤疗效评价标准(mRECIST)和RECIST v1.1评估的总缓解率(ORR)和缓解持续时间(DOR),次要终点包括无进展生存期(PFS)、疾病进展时间(TTP)、总生存期(OS)。
在数据截止(2019年10月31日)和中位随访10.6个月(95%CI:9.2-11.5)时,37例患者仍在研究中(Keytruda+Lenvima:n=34;Lenvima:n=3),Keytruda+Lenvima联合治疗的中位持续时间为7.9个月(范围:0.2-31.1)。
主要终点的最终分析显示:IIR根据mRECIST标准评估确定,Keytruda+Lenvima联合治疗的ORR为36%(n=36;95%CI:26.6-46.2)、完全缓解率(CR)为1%(n=1)、部分缓解率(PR)为35%(n=35)、中位DOR为12.6个月(95%CI:6.9-不可评估[NE])。IIR根据RECIST v1.1标准评估确定,Keytruda+Lenvima联合治疗的ORR为46%(n=46;95%CI:36.0-56.3)、完全缓解率(CR)为11%(n=11)、部分缓解率(PR)为35%(n=35)、中位DOR为8.6个月(95%CI:6.9-不可评估[NE])。治疗相关不良事件(TRAE)导致6%的患者停用Keytruda+Lenvima、10%的患者停用Keytruda、14%的患者停用Lenvima。
Keytruda是一种抗PD-1肿瘤免疫疗法,通过提高人体免疫系统的能力来帮助检测和对抗肿瘤细胞。Keytruda是一种人源化单克隆抗体,阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞。
Lenvima是由卫材内部发现和开发的一种靶向药物,该药是一种口服多受体酪氨酸激酶(RTK)抑制剂,具有新颖的结合模式,除了抑制参与肿瘤血管生成、肿瘤进展及肿瘤免疫修饰的其他促血管生成和致癌信号通路相关RTK(包括血小板衍生生长因子(PDGF)受体PDGFRα,KIT和RET)之外,还能够选择性抑制血管内皮生长因子(VEGF)受体(VEGFR1,VEGFR2,VEGFR3)和成纤维细胞生长因子(FGF)受体(FGFR1,FGFR2,FGFR3,FGFR4)的激酶活性。
Keytruda+Lenvima组合疗法是默沙东与卫材肿瘤学战略合作的一部分。2018年3月,双方签署了总额高达58亿美元的合作协议,开发Lenvima单药以及与Keytruda联合用药用于多种类型肿瘤的治疗。除了目前正在进行的评估Keytruda与Lenvima组合治疗包括肾细胞癌在内的几种不同类型肿瘤之外,双方还通过LEAP临床项目启动了新的临床研究,并正在评估13种不同类型肿瘤(子宫内膜癌、肝细胞癌、黑色素瘤、非小细胞肺癌、肾细胞癌、头颈部鳞状细胞癌、尿路上皮癌、胆道癌、三阴性乳腺癌、结直肠癌、胃癌、胶质母细胞瘤、卵巢癌)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


