结直肠癌精准医疗!默沙东Keytruda获美国FDA批准单药一线治疗MSI-H/dMMR患者,将改变治疗模式
来源:本站原创 2020-06-30 19:54
提交申请不到1个月获批,Keytruda有潜力改变一线治疗MSI-H结直肠癌患者的治疗模式。

2020年06月30日讯 /生物谷BIOON/ --默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已批准抗PD-1疗法Keytruda(可瑞达,通用名:pembrolizumab,帕博利珠单抗),作为一种单药疗法,一线治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)、不可切除性或转移性结直肠癌(mCRC)患者。
值得一提的是,Keytruda是被批准用于MSI-H/dMMR mCRC患者一线治疗的第一个单药抗PD-1疗法,有潜力改变一线治疗MSI-H结直肠癌患者的治疗模式。根据KEYNOTE-177研究的结果,在提交补充生物制品许可申请(sBLA)后不到一个月,就收到了FDA的批准。
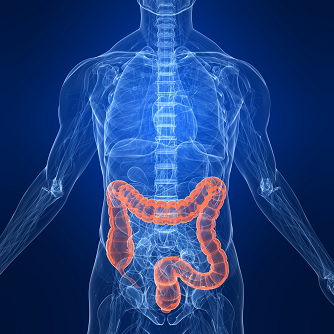
此次最新批准基于关键III期KEYNOTE-177研究的结果。值得一提的是,该研究是比较单一制剂抗PD-1疗法与标准护理化疗用于一线治疗MSI-H或dMMR结直肠癌的第一个阳性头对头III期研究。数据显示,与目前的标准护理(SOC)化疗(mFOLFOX6或FOLFIRI,联用或不联用贝伐单抗或西妥昔单抗,由研究员选择)相比,Keytruda单药治疗将疾病进展或死亡风险显著降低40%(HR=0.60[95%CI:0.45-0.80];p=0.0004)、将中位无进展生存期(PFS)增加一倍以上(16.5个月[95%CI:5.4-32.4] vs 8.2个月[95%CI:6.1-10.2])。
默沙东研究实验室高级副总裁兼全球临床开发主管、首席医疗官Roy Baynes博士表示:“根据KEYNOTE-177研究的重要发现,今天的批准有潜力改变MSI-H结直肠癌患者一线治疗的治疗模式,该研究结果显示Keytruda单药疗法比标准化疗具有更高的无进展生存期。我们持续致力于生物标志物研究,这将继续帮助我们为患者带来新的治疗方法,特别是对于那些几乎没有可用选择的患者。”
KEYNOTE-177(NCT02563002)是一项随机、开放标签III期试验,共入组了307例MSI-H或dMMR、不可切除性或转移性CRC患者。研究中,这些患者被随机分配,接受Keytruda(每3周一次静脉输注200mg,最多35个疗程)或研究员选择的6种SOC化疗方案中的一种(mFOLFOX6;mFOLFOX6+贝伐单抗;mFOLFOX6+西妥昔单抗;FOLFIRI;FOLFIRI+贝伐单抗;FOLFIRI+西妥昔单抗)。
结果显示,与化疗相比,Keytruda单药一线治疗将疾病进展或死亡风险显著降低40%(HR=0.60;95%CI:0.45-0.80;p=0.0002)、无进展生存期延长一倍(中位PFS:16.5个月 vs 8.2个月)。Keytruda组2年无进展生存率为48%、化疗组为19%。Keytruda组和化疗组的总缓解率(ORR)分别为43.8%、33.1%,完全缓解率(CR)分别为11.1%和3.9%,部分缓解率(PR)分别为32.7%和29.2%。Keytruda组的中位缓解持续时间(DOR)尚未达到(范围:2.3+至41.4+)、化疗组为10.6个月(范围:2.8至37.5+)。此外,Keytruda组有83%的患者缓解持续至少2年,化疗组为35%。该研究中,59%的意向治疗人群在停止化疗组的研究治疗后接受了随后的抗PD-1/PD-L1治疗。
该研究中,Keytruda的安全性分析显示,≥3级治疗相关不良事件(TRAE)发生率低于化疗组(22% vs 66%),且未观察到新的毒性反应。免疫介导的不良反应和输注反应,Keytruda治疗组发生率为31%、化疗组为13%。最常报告的免疫介导不良事件,Keytruda组为甲状腺功能减退症(12%)和结肠炎(7%),化疗组为输注反应(8%)。
根据独立数据监测委员会(DMC)的建议,该研究将继续推进,不作任何改变,以评估双重主要终点之一的总生存期(OS)。
结肠直肠癌(CRC)是一种病发部位位于结肠或直肠的癌症,而结肠或直肠是身体消化或胃肠道系统的一部分。CRC是全球第三大最常见癌症、也是第二大癌症相关死亡原因。据估计,2018年全球确诊CRC新病例近85万例,死亡超过88万。在2020年,美国预计将确诊10.5万结肠癌新病例和4.3万直肠癌新病例,5.3万人死于结直肠癌。晚期/转移性结肠癌和直肠癌(IV期)的5年生存率分别为14%和15%。
微卫星不稳定(MSI)是由美国国家癌症研究所(NCI)定义的一种发生在某些细胞(如肿瘤细胞)DNA中的变化,在这种变化中,微卫星的重复次数(短而重复的DNA序列)与遗传时DNA中的重复次数不同。微卫星不稳定的原因可能是在细胞中复制DNA时,修复错误的能力有缺陷。这种缺陷也被称为错配修复缺陷(dMMR)。据估计,大约10-15%的CRC患者在进行检测时肿瘤评定为MSI-H或dMMR。
dMMR或MSI-H mCRC患者不大可能受益于常规化疗方案,通常预后非常差,存活率也低。因此,应对所有CRC患者进行dMMR或MSI-H状态的常规检查。
Keytruda是属于PD-(L)1肿瘤免疫疗法,通过提高人体免疫系统的能力来帮助检测和对抗肿瘤细胞。Keytruda是一种人源化单克隆抗体,阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞。
截止目前,在全球范围内,已有11款PD-(L)1肿瘤免疫疗法获批,其中Keytruda是该领域的领头羊,已批准20多个治疗适应症,2019年全球销售额达到111亿美元,较上一年增长幅度高达58%。
默沙东拥有业界最大规模的免疫肿瘤学临床开发项目,目前有超过1200个临床试验正在调查Keytruda在多种类型肿瘤和治疗背景中的作用。Keytruda临床项目旨在了解该药在癌症中的作用以及可能预测患者从Keytruda治疗中受益的因素,包括探索几种不同的生物标志物。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


