研究研究发现氧依赖的分泌型细胞内吞体通道调控机制
来源:昆明动物研究所 2020-06-13 16:50
以两栖动物为模型开展的研究为生命科学进程做出了很多杰出的原创性贡献,如肌肉代谢、神经传导的化学基础、体细胞克隆等。两栖动物的皮肤担任呼吸、水平衡、粘膜屏障和免疫的重要生理功能,但对其中的细胞生物学原理和分子生物学基础知之甚少。与人们熟悉的传统膜蛋白(包括膜受体、离子通道和转运体等)不同,孔道形成蛋白(Pore-forming protein)是一类非经典膜蛋
以两栖动物为模型开展的研究为生命科学进程做出了很多杰出的原创性贡献,如肌肉代谢、神经传导的化学基础、体细胞克隆等。两栖动物的皮肤担任呼吸、水平衡、粘膜屏障和免疫的重要生理功能,但对其中的细胞生物学原理和分子生物学基础知之甚少。与人们熟悉的传统膜蛋白(包括膜受体、离子通道和转运体等)不同,孔道形成蛋白(Pore-forming protein)是一类非经典膜蛋白,其特征在于以分泌型单体可溶性形式存在,特定条件下通过寡聚化后再插入生物膜系统形成膜通道。目前对孔道形成蛋白的认识主要集中于它们的细胞毒作用,而对它们其他的细胞功能和作用途径知之甚少。
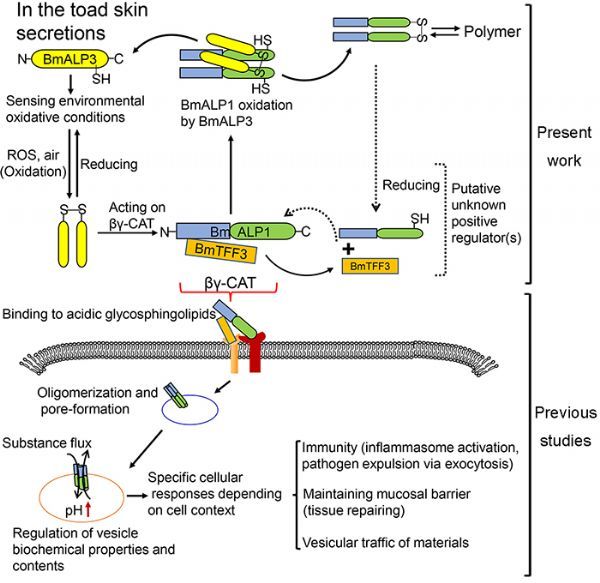
中国科学院昆明动物研究所生物毒素与人类疾病课题组在研究员张云的带领下,前期从云南两栖动物大蹼铃蟾(Bombina maxima)中发现了脊椎动物第一个新型孔道形成蛋白和三叶因子复合物CAT(发明专利ZL200810058028.5;PLoS One, 2008)。以该蛋白质机器为模式分子,该课题组经过长期的研究揭示了全新的细胞调控策略和分子作用途径,即分泌型孔道形成蛋白作用于细胞内吞/溶酶体形成特定物质通道,进而调节细胞状态和功能,因此CAT代表了一类迄今未知的分泌型细胞内吞体通道蛋白。该通道蛋白首先在细胞外进行组装,再以双受体结合模式内吞入胞(Commun Biol. 2019),在细胞内吞/溶酶体中形成膜通道并调控其生化特性,包括物质交换和pH等,在宿主天然免疫、粘膜屏障修复和细胞物质运输中发挥了重要作用(Proc Natl Acad Sci. USA 2014, 封面故事;J Infect Dis 2017;FASEB J. 2019)。日前,昆明动物所与中国科学技术大学合作,进一步揭示了该分泌型细胞内吞体通道胞外组装氧依赖的同源蛋白调控机制。该研究首先鉴定到一个CAT的同源蛋白,其特征在于无膜通道形成能力,但却能感知环境的氧分压并在单体和二聚体之间转换,进而通过二硫键交换的方式负调控CAT组装和生物活性;缺氧状态下,该调节性同源蛋白失活进而解除效应蛋白质机器CAT的抑制状态,促进细胞应激和体内炎症反应;而且所发现的氧依赖调控的结构基础在动植物来源的同源蛋白质中具有广泛的保守性。该研究不仅进一步夯实了分泌型细胞内吞体通道作用途径存在的生物学意义及生理作用,为人们深入研究缺氧应激和炎症反应的细胞分子策略和机制提供了新的思路和线索,同时对理解人类疾病的机理和药物研发也具有积极的科学意义。
论文以A cellular endolysosome-modulating pore-forming protein from a toad is negatively regulated by its paralog under oxidizing conditions为题,在线发表于美国生物化学与分子生物学学会会刊 (Journal of Biological Chemistry)。昆明动物所王齐权、卞显玲和曾琳为文章的共同第一作者,昆明动物所张云、郭小龙和中国科大李旭为文章的共同通讯作者。该研究获得国家基金委-云南联合基金重点项目、“云岭学者”计划以及国家基金委面上项目的资助。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->