研究阐明人胞质亮氨酰-tRNA合成酶多功能调控的分子基础
来源:分子细胞科学卓越创新中心 2020-06-04 07:24
国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王恩多研究组与上海科技大学刘如娟研究组的最新研究成果“Molecular basis of the multifaceted functions of human leucyl-tRNA synthetase in
国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王恩多研究组与上海科技大学刘如娟研究组的最新研究成果“Molecular basis of the multifaceted functions of human leucyl-tRNA synthetase in protein synthesis and beyond”。
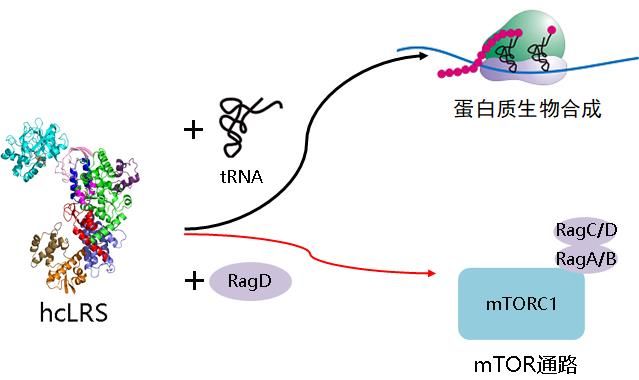
人胞质亮氨酰-tRNA合成酶(hcLRS)是由十个结构域组成的复杂的多功能氨基酰-tRNA合成酶(aaRS)。除了经典的催化tRNA氨基酰化的功能,为蛋白质合成提供原料外,hcLRS还可以作为亮氨酸感受器,通过与RagD直接相互作用调控雷帕霉素复合物1(mTORC1)信号通路。同时,它还参与了细胞质多氨酰基-tRNA合成酶复合物(MSC)的组装。然而,目前hcLRS多功能的分子基础和参与MSC组装的机制都不清楚,特别是hcLRS如何在感受亮氨酸后从氨基酰化功能转换到结合RagD去调控亮氨酸感受器。
博士龙韬、博士研究生李浩及其同事在分子细胞卓越中心王恩多和上海科技大学刘如娟(原王恩多研究组研究员)的指导下合作解析了hcLRS 2.5的晶体结构,是目前解析的第一个完整的真核LRS结构。结合生物化学实验和酶学动力学研究,他们揭示了hcLRS的氨基酰化和编校活性中心关键氨基酸残基的作用;发现tRNA和RagD都结合到hcLRS的VC(vertebrate C-terminal)结构域,它们与hcLRS的结合是互相排斥的,为hcLRS发挥tRNA氨基酰化的经典功能和非经典功能的转换提供结构基础;阐明了hcLRS通过与异亮氨酰-tRNA合成酶(IRS)的直接相互作用参入到MSC中;基于hcLRS的结构,他们还分析了靶向hcLRS不同结构域的多种小分子化合物的结合方式并提供了优化这些化合物的方案。他们的研究结果为hcLRS的生物学功能和靶向LRS药物的合理设计提供了新的认识。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


