Cell及其子刊新突破:中国科学家成功开发SARS-CoV-2小鼠模型
来源:本站原创 2020-06-03 15:15
2020年6月3日讯 /生物谷BIOON /——动物模型对于病毒的病理学、疫苗开发和药物筛查至关重要。非人类的灵长类动物模型是临床前实验常用的动物模型,但是费用昂贵、使用不便、需要的设施相对复杂,这限制了这种动物模型在SARS-CoV-2中的应用。小鼠模型是一种更理想的临床前实验模型,因为其价格便宜、更容易获得,同时饲养条件简单。但是小鼠并不表达SARS-C
2020年6月3日讯 /生物谷BIOON /——动物模型对于病毒的病理学、疫苗开发和药物筛查至关重要。非人类的灵长类动物模型是临床前实验常用的动物模型,但是费用昂贵、使用不便、需要的设施相对复杂,这限制了这种动物模型在SARS-CoV-2中的应用。小鼠模型是一种更理想的临床前实验模型,因为其价格便宜、更容易获得,同时饲养条件简单。但是小鼠并不表达SARS-CoV-2用于进入人体细胞的人血管紧张素转换酶2(ACE2)。因此开发新的适用于SARS-CoV-2研究的小鼠模型有助于推动相关病毒学研究及治疗靶点和药物的研究和开发。
近日,在两项分别发表在Cell和Cell Host & Microbe上的研究论文中,来自中国的科学家们开发了可以用于SARS-CoV-2和COVID-19研究的小鼠模型,为SARS-CoV-2及COVID-19提供了一种方便实用而经济实惠的动物模型。
图片来源:Cell
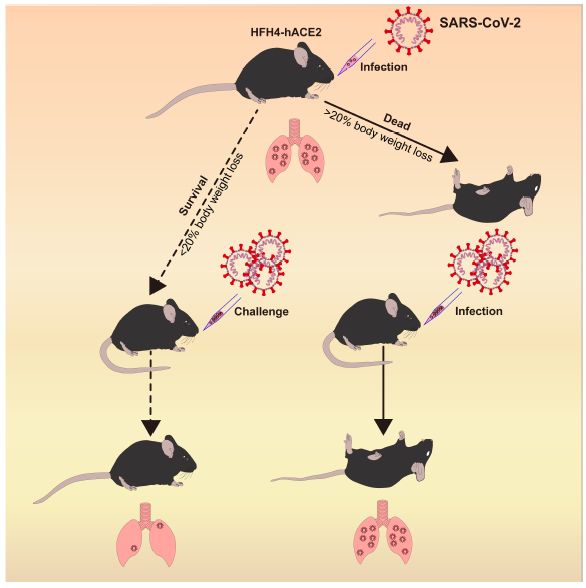
在第一项发表在Cell(Pathogenesis of SARS-CoV-2 in transgenic mice expressing human angiotensin-converting enzyme 2.)上的研究中,来自中科院武汉病毒研究所、中国科学院大学、华中科技大学同济医学院和北卡罗来纳大学教堂山分校的研究人员开发了一种表达人血管紧张素转换酶2(ACE2)的转基因小鼠(HFH4-hACE2 in C3B6 mice),研究人员发现这种小鼠感染SARS-CoV-2后的肠道、肺炎症状及病理学特征与COVID-19患者很相似。
通过对病毒的检测,研究人员确定了这种小鼠的肺是病毒感染的主要器官,但是研究人员在一些小鼠的眼睛、心脏和大脑中也检测到了病毒RNA。此外,研究人员还从感染小鼠的肺部和脑部组织中分离出了SARS-CoV-2的全基因组。
最后,研究人员发现预先接触SARS-CoV-2可以防止小鼠再次感染时出现严重肺炎。总的来说,这项研究表明这种新的hACE2小鼠模型是研究SARS-CoV-2疫苗和药物的一种非常有价值的工具。
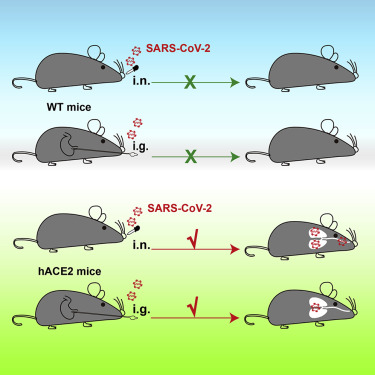
第二项研究发表在Cell Host & Microbe(A mouse model of SARS-CoV-2 infection and pathogenesis)上,研究人员在一种感染SARS-CoV-2的小鼠模型再现了在人类患者中观察到的特征。利用CRISPR/Cas9基因编辑技术,研究人员得到了能够产生人类血管紧张素转换酶II (hACE2)的老鼠,这种受体是SARS-CoV-2结合并用来进入人类细胞的。
中国国家食品和药物控制研究所(NIFDC)的共同高级研究作者Wang You-Chun说:"非常需要一个小动物模型来复制在COVID-19患者中观察到的临床过程和病理。这里描述的动物模型为研究SARS-CoV-2感染和传播提供了一个有用的工具。"
Wang和他的同事使用CRipsR/Cas9生成了能够表达hACE2的小鼠模型。据作者介绍,与其他表达hACE2的基因工程小鼠相比,他们的小鼠模型在模拟SARS-CoV-2感染方面具有一些优势。hACE2并不是随机插入的,而是精确地插入到X染色体的特定位置,它完全取代了小鼠版本的蛋白质。此外,这是一个基因稳定的模型,个体之间几乎没有差异。肺部的病毒RNA载量要高得多,由此产生的hACE2在各种组织中的分布情况与人类的情况更为吻合。
在通过鼻子感染SARS-CoV-2后,基因工程小鼠在肺、气管和大脑中显示出病毒RNA复制旺盛的证据。中国军事医学科学院(AMMS)的共同高级研究作者Cheng-Feng Qin说:"大脑中出现病毒RNA多少有些出乎意料,因为只有少数COVID-19患者出现了神经系统症状。"
SARS-CoV-2 S蛋白与hACE2结合进入宿主细胞,也存在于肺组织和脑细胞中。此外,研究人员还确定了SARS-CoV-2靶向的主要气道细胞是产生CC10蛋白的Clara细胞。"我们的结果提供了证明SARS-CoV-2在肺中的主要靶细胞的第一道证据,"AMMS的共同高级研究作者Yu-Sen Zhou说。
图片来源:Cell Host & Microbe
此外,小鼠还出现了间质性肺炎,影响肺气囊周围的组织和空间,导致炎症细胞浸润、分离气囊的结构增厚和血管损伤。与年轻的小鼠相比,年老的小鼠表现出更严重的肺损伤和称为细胞因子的信号分子的产生。综上所述,这些特征概括了在COVID-19患者中观察到的特征。
当研究人员将SARS-CoV-2注入胃中时,三只小鼠中的两只在气管和肺中显示出了高水平的病毒RNA。S蛋白也存在于肺组织,有炎症迹象。作者认为,这些发现与观察到的COVID-19患者有时会出现腹泻、腹痛和呕吐等胃肠道症状是一致的。但是,通过胃而不是通过鼻子感染,需要10倍剂量的SARS-CoV-2。
未来利用这些小鼠模型进行的研究,可能有助于阐明SARS-CoV-2如何侵入大脑,以及该病毒如何在胃肠道环境中存活并侵入呼吸道。研究人员表示:"我们的研究描述的hACE2小鼠为理解人类SARS-CoV-2感染的意外临床表现提供了一个小动物模型,这个模型对于测试疫苗和治疗方法来对抗SARS-CoV-2也很有价值。"(生物谷Bioon.com)
参考资料:
Pathogenesis of SARS-CoV-2 in transgenic mice expressing human angiotensin-converting enzyme 2. Published:May 21, 2020DOI:https://doi.org/10.1016/j.cell.2020.05.027
Shi-Hui Sun et al, A mouse model of SARS-CoV-2 infection and pathogenesis,Cell Host & Microbe (2020). DOI: 10.1016/j.chom.2020.05.020
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


