“减少损伤+加强修复”!百时美施贵宝多发性硬化新药:口服S1P受体调节剂Zeposia获美国欧盟批准
来源:本站原创 2020-05-28 17:12
Zeposia是唯一一个被批准用于治疗有活动性疾病的RRMS患者的鞘氨醇-1-磷酸(S1P)受体调节剂。

2020年05月28日讯 /生物谷BIOON/ --百时美施贵宝(BMS)近日宣布,欧盟委员会(EC)已批准Zeposia(ozanimod),用于治疗有活动性疾病(定义为:有临床或影像学特征)的复发-缓解型多发性硬化症(RRMS)成人患者。该药每日口服一次,将为欧洲的RRMS患者群体提供一种新的口服治疗选择,帮助解决该病的特征性复发和脑损伤。
Zeposia是一种鞘氨醇-1-磷酸(S1P)受体调节剂,以高亲和力选择性地与S1P亚型1(S1P1)和5(S1P5)结合。特别值得一提的是,随着此次欧盟批准,Zeposia成为唯一一个被批准用于治疗有活动性疾病的RRMS患者的S1P受体调节剂:在启动治疗时,对大多数患者无需进行首次剂量观察。首次剂量监测仅推荐用于存在某些先天性心脏病的高危患者。由于可能发生心率短暂下降和房室传导延迟,因此应采用剂量递增方案从第1天到第7天达到Zeposia的维持剂量。
在美国,Zeposia已于今年3月25日获得批准,用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征、复发缓解性疾病、活动性继发进展性疾病。
Zeposia由新基研制,该药也标志着百时美施贵宝完成收购新基以来所获得的资产在美国和欧盟获得批准的第一个药物,将扩大百时美施贵宝在免疫学领域的专营权。
百时美施贵宝首席医疗官Samit Hirawat医学博士表示:“今天欧盟委员会的批准,为有活动性疾病的RRMS患者提供了一个机会,将Zeposia作为一种新的一线治疗方案,这是一个重大的进步。来自III期临床试验的结果证实,Zeposia能够显著改善由这种毁灭性疾病引起的复发和脑损伤。我们将与所有利益相关者密切合作,确保符合资格的欧洲患者能够尽快开始从Zeposia获益。”

此次批准,基于随机、阳性药物对照III期SUNBEAM和RADIANCE Part B临床试验的数据。这2项试验在全球20多个国家的150个临床中心入组了超过2600例患者。2项研究中,在疾病活动的一个关键临床指标——年复发率(ARR)方面,与Avonex(干扰素β-1a)相比,Zeposia表现出显著疗效,具体数据为:(1)在SUNBEAM试验中,与Avonex相比,Zeposia治疗1年将ARR相对降低48%(绝对ARR:0.18 vs 0.35);(2)在RADIANCE试验中,与Avonex相比,Zeposia治疗2年将ARR相对降低38%(绝对ARR:0.17 vs 0.28)。
此外,与Avonex相比,Zeposia也减少了脑损伤数量和病灶大小。具体数据为:(1)在SUNBEAM试验中,治疗1年,Zeposia与Avonex相比将T1加权钆增强(GdE)脑损伤的数量(0.16 vs 0.43)相对减少了63%、将新的或扩大的T2损伤的数量(1.47 vs 2.84)相对减少了48%。(2)在RADIANCE试验中,治疗2年,Zeposia与Avonex相比将T1加权钆增强(GdE)脑损伤的数量(0.18 vs 0.37)相对减少了53%、将新的或扩大的T2损伤的数量(1.84 vs 3.18)相对减少了42%。
此外,与Avonex相比,Zeposia显示全脑容量(WBV)相对基线的百分比变化降低(SUNBEAM试验中,治疗1年:-0.41% vs -0.61%;RADIANCE试验中,治疗2年:-0.71% vs -0.94%)。
2项试验中,Zeposia显示出可管理的安全性和耐受性。欧洲多发性硬化平台(European Multiple Sclerosis Platform)总裁Pedro Carrascal表示:“多发性硬化症是一种不可预测且经常致残的疾病,影响着欧洲约70万人。我们很高兴,现在患者有了另一种治疗方法可以潜在地延缓这种致衰性疾病的进展。”
多发性硬化症(MS)是一种免疫系统攻击覆盖神经的保护性髓鞘的疾病。髓鞘损伤可破坏大脑和身体其他部分之间的通讯。最终,神经本身可能恶化,这一过程目前是不可逆的。多发性硬化症影响全球约250万人,影响欧洲约70万人。
复发缓解型多发性硬化(RRMS)的特征是明确定义的神经功能恶化的发作,这些发作通常被称为复发、耀斑或病情加重,随后是部分或完全恢复期(缓解期),在此期间症状部分或完全改缓解,没有明显的疾病进展。RRMS是诊断时最常见的病程。大约85%的患者最初被诊断为RRMS,而10-15%的患者为进展型MS。
Zeposia的活性药物成分ozanimod是一种口服S1P受体调节剂,以高亲和力选择性结合S1P1和S1P5。ozanimod选择性结合S1P1被认为能够抑制一个特定亚组的活化淋巴细胞迁移到炎症区域,减少可导致抗炎活性的循环T淋巴细胞与B淋巴细胞的水平,从而缓解免疫系统对神经髓鞘进行攻击。由于ozanimod的特殊作用机理,患者的免疫监视机能得以维持。而ozanimod与S1PR5的结合则能激活中枢神经系统内的特殊细胞,促进髓鞘再生,并预防突触出现缺陷,最终可预防神经损伤。在“减少损伤+加强修复”这2种机制的共同作用下,ozanimod有潜力改善多种免疫疾病的症状。
目前,鞘氨醇-1-磷酸(S1P)受体已成为MS领域新药研发的一个重要靶点。2019年3月,诺华Mayzent(siponimod)获美国FDA批准,用于RMS成人患者的治疗,包括活动性继发进展型多发性硬化症(SPMS)、复发缓解型多发性硬化症(RRMS)、临床孤立综合征(CIS)。值得一提的是,Mayzent是过去15年来首个专门批准用于活动性SPMS患者的治疗药物。Mayzent的活性药物成分为siponimod,这是一种新一代、选择性S1P受体调节剂,能选择性地与S1P受体1(S1P1)和受体5(S1P5)结合,作用机理与百时美施贵宝的Zeposia相同。
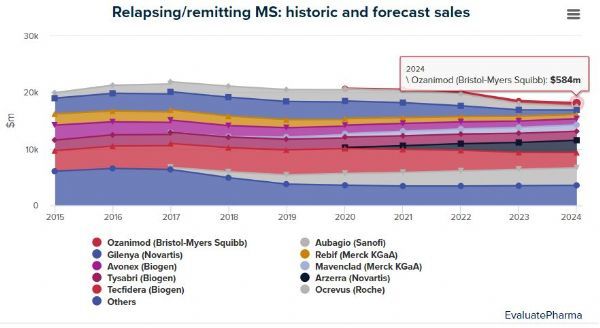
Zeposia上市后,将面临多款口服药物的竞争,例如诺华的Gilenya和Mayzent、赛诺菲的Aubagio、渤健的Tecfidera和Vumerity、默克的Mavenclad,以及罗氏的每年仅需输注2次的抗体药物Ocrevus。根据医药市场调研机构EvaluatePharma共识预测,Zeposia有潜力入围《2024年十大畅销复发/缓解型多发性硬化症药物》有分析师预计,该药在2024年的销售额将达到9.66亿美元,其中约一半来自其他适应症。目前,Zeposia也正被开发用于多种免疫炎症适应症,包括溃疡性结肠炎(UC)、克罗恩病(CD)等。
值得一提的是,今年3月,强生在欧盟和美国提交了ponesimod治疗复发型多发性硬化症(RMS)成人患者的上市申请,该药是一种新型、口服、选择性S1P1调节剂,可功能性抑制S1P蛋白的活性。在评估2种口服药物治疗RMS的首个大规模对照头对头III期OPTIMUM研究(NCT02425644)中,ponesimod疗效击败赛诺菲药物Aubagio(奥巴捷,teriflunomide,特立氟胺),后者是一款行业领先的RMS口服药物,已在全球70多个国家上市。在中国,Aubagio(奥巴捷)于2018年7月获批上市,是国内批准治疗多发性硬化症的首个口服疾病修正治疗药物。(生物谷Bioon.com)
原文出处:Bristol Myers Squibb Receives European Commission approval for Zeposia (ozanimod) for the Treatment of Adult Patients with Relapsing Remitting Multiple Sclerosis with Active Disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->