20多年来重大突破!新型IFN-γ阻断抗体Gamifant治疗超罕见病(HLH)移植后存活率高达90%!
来源:本站原创 2020-05-10 16:23
Gamifant是第一个也是唯一一个被批准治疗原发性噬血细胞性淋巴组织细胞增多症(HLH)的药物。

2020年05月10日讯 /生物谷BIOON/ --瑞典制药公司Swedish Orphan Biovitrum AB(SOBI)近日宣布,评估Gamifant(emapalumab)治疗原发性噬血细胞性淋巴组织细胞增多症(HLH)疗效和安全性的关键II/III期临床研究(NCT01818492)的结果已于2020年5月7日发表于国际顶级医学期刊《新英格兰医学杂志》(NEJM)。
HLH是一种罕见的炎症综合征,通常发生在生命的第一年内,若得不到诊断和治疗,很快会致命。2018年11月,Gamifant获美国FDA批准上市,是第一个也是唯一一个获批治疗原发性HLH的药物,该药目前正在接受欧洲药品管理局(EMA)的审查。
NEJM上发表的结果显示,Gamifant治疗的总缓解率(ORR)超过60%,治疗后病情缓解并继续进行造血干细胞移植(HSCT)的患者,存活率非常高,达到了90%。研究期间,Gamifant的安全性良好。
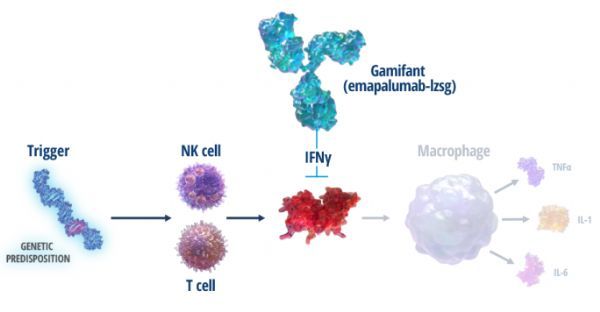
原发性HLH是一种非常罕见的高度炎症综合征,通常出现在婴儿期,但也可见于成人,与高发病率和高死亡率相关。这种危及生命的疾病的特点是免疫失调和失控的炎症反应。短期治疗目标是抑制炎症反应、控制疾病的急性发作,使患者顺利进行造血干细胞移植(HSCT)。
HLH是一种免疫调节紊乱性疾病,其中许多细胞因子紊乱。临床前数据显示,干扰素γ(IFNγ)在这种疾病的发病机制中起着中心作用。
Gamifant是一种干扰素γ(INFγ)阻断抗体,于2018年11月底获美国FDA批准,用于难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性HLH儿童(新生儿及以上)和成人患者。之前,FDA已授予Gamifant孤儿药资格、突破性药物资格、罕见儿科疾病资格、优先审查资格。
Gamifant具有一种靶向作用模式。此次批准,使Gamifant成为全球首个专门治疗HLH的药物,标志着原发性HLH临床治疗领域24年来的首个重大突破。Gamifant由Novimmune SA公司研制。2018年7月,Sobi以4.52亿美元收购Novimmune SA,获得了这款药物。
NEJM上发表的这项研究,是一项全球性、多中心、开放标签、单臂、关键性研究,共入组了34例年龄≤18岁的原发性HLH患者,评估了Gamifant与地塞米松联合用药,其中地塞米松剂量在研究期间可以逐渐降低。34例患者中,7例在入组研究前未接受过治疗(初治组),27例接受过常规治疗(经治组)。所有患者在入组研究时均有活动性疾病,经治组27例患者接受常规治疗期间或之后病情恶化或复发、或接受常规疗法未获得满意应答、或因副作用无法继续接受常规治疗。
截至2017年7月20日,接受Gamifant治疗的34例患者中,有26例完成了研究。数据显示:(1)在完成8周治疗后,经治组(n=27)和整个研究组(n=34)分别有63%、65%的患者病情缓解,这些百分比显著高于预先指定的40%的无效假设阈值(分别为p=0.02和p=0.005)。(2)经治组(n=27)和整个研究组(n=34)分别有70%、65%的患者能够开展造血干细胞移植并且接受了移植。(3)在最后一次观察中,经治组(n=27)、整个研究组(n=34)分别有74%、71%的患者仍然存活。(4)患者移植后表现出非常高的存活率,经治组和整个研究组接受了移植的患者中,12个月存活率分别为89.5%、90.2%。
安全性方面,Gamifant与任何器官毒性无关,治疗期间有10例患者出现严重感染,1例因播散性组织胞浆菌病停用Gamifant。最常报告的不良反应(≥20%)是感染、高血压、输液相关反应和发热。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->