卵巢癌一线维持治疗新方案!阿斯利康/默沙东Lynparza(利普卓)与贝伐单抗组合获美国FDA批准!
来源:本站原创 2020-05-09 15:38
一线维持治疗同源重组缺陷(HRD)阳性晚期卵巢癌成人患者,约占晚期卵巢癌的50%。

2020年05月09日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)与合作伙伴默沙东(Merck & Co)近日联合宣布,美国食品和药物管理局(FDA)已批准Lynparza(中文品牌名:利普卓,通用名:olaparib,奥拉帕利片剂)联合贝伐单抗(bevacizumab)一线维持治疗同源重组缺陷(HRD)阳性晚期卵巢癌成人患者,具体为:接受一线含铂化疗病情获得完全缓解或部分缓解、由有害或疑似有害BRCA突变和/或基因组不稳定性(genomic instability)所定义的HRD阳性的晚期卵巢癌(上皮性卵巢癌、输卵管癌、原发性腹膜癌)成人患者。
Lynparza治疗的目标患者,将根据FDA批准的一款伴随诊断试剂盒进行筛查确定。据估计,在晚期卵巢癌患者中,约50%为HRD阳性肿瘤患者。对于晚期卵巢癌患者,一线维持治疗的主要目的是尽可能地延缓病情进展。
Lynparza是一种首创、口服多聚ADP核糖聚合酶(PARP)抑制剂,已获批6个治疗适应症,其中4个是卵巢癌、2个是一线维持治疗卵巢癌。具体为:(1)一线维持治疗BRCAm晚期卵巢癌成人患者;(2)联合贝伐单抗一线维持治疗HRD阳性晚期卵巢癌成人患者;(3)维持治疗复发性卵巢癌成人患者;(4)晚期gBRCAm卵巢癌成人患者;(5)gBRCAm、HER2阴性(HER2-)转移性乳腺癌成人患者;(5)一线维持治疗gBRCAm转移性胰腺癌成人患者。
此次批准,基于III期PAOLA-1研究中HRD阳性肿瘤患者的生物标记物亚组(n=387)分析数据。结果显示,在HRD阳性晚期卵巢癌患者中,与贝伐单抗单药维持治疗相比,Lynparza联合贝伐单抗维持治疗将疾病进展或死亡风险显著降低67%(HR=0.33[95%CI:0.25-0.45])、无进展生存期显著延长(中位PFS:37.2个月 vs 17.7个月)。
卵巢癌是美国女性中癌症死亡的第五大常见原因。据估计,在2020年,将有2.1万名女性确诊为卵巢癌,死亡近1.4万名。卵巢癌患者在确诊时通常已处于晚期,5年生存率约为48%。对于新诊断的晚期卵巢癌,治疗的主要目的是尽可能地延缓病情的发展,以及维持患者的生活质量,并以达到完全缓解或治愈为目的。在卵巢癌患者中,约22%存在BRCA1/2突变,约50%为HRD阳性。
阿斯利康肿瘤业务部门负责人、执行副总裁Dave Frederickson表示:“这一批准标志着Lynparza在卵巢癌治疗方面的又一个里程碑。超过三年的中位无进展生存期(PFS)为卵巢癌女性患者延迟疾病复发提供了新的希望。这些结果进一步证实,HRD阳性是卵巢癌的一个独特亚型,HRD检测是晚期卵巢癌诊断和治疗的关键组成部分。”
PAOLA-1是一项双盲研究,在接受含铂化疗和贝伐单抗一线治疗病情获得完全缓解或部分缓解的新诊晚期FIGO III-IV期高级别浆液性或子宫内膜样卵巢、输卵管或腹膜癌患者中开展,评估了Lynparza与标准护理(SoC)贝伐单抗联合治疗相对于贝伐单抗单药疗法用作一线维持治疗的疗效和安全性。
该研究结果已发表于《新英格兰医学杂志》。结果显示,用于一线维持治疗时,与贝伐单抗单药治疗相比,Lynparza与贝伐单抗联合治疗使无进展生存期(PFS)取得了统计学意义和临床意义的改善,不论患者的基因生物标志物状态或先前手术结果如何。
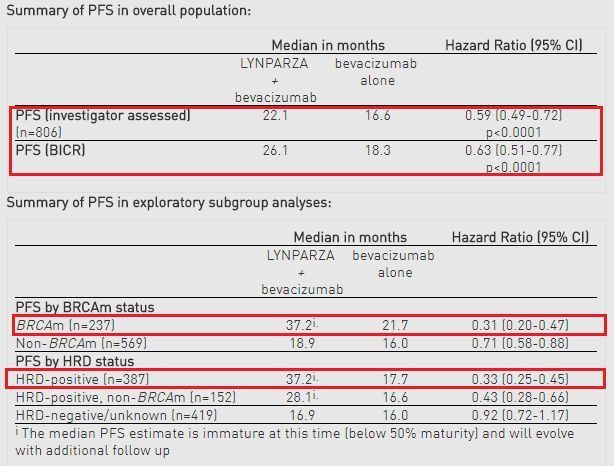
具体数据为:调查员评估的结果显示,与贝伐单抗单药治疗组相比,Lynparza+贝伐单抗联合治疗组疾病进展或死亡风险降低41%(HR=0.59)、疾病无进展生存期显著延长(22.1个月 vs 16.6个月;p<0.0001)。在研究开始后的2年时间点,Lynparza+贝伐单抗联合治疗有46%的患者没有疾病进展,而贝伐单抗单药治疗组比例为28%。
盲法独立中心审查(BICR)的PFS敏感性分析结果一致,显示出类似的改善:Lynparza+贝伐单抗联合治疗组中位PFS为26.1个月,贝伐单抗单药治疗组为18.3个月(HR=0.63;95%CI:0.51-0.77,p<0.0001)。该研究中,Lynparza和贝伐单抗的安全性及耐受性与之前每种药物的研究结果一致,对生活质量没有损害。
该研究还包括探索性分组分析,包括BRCA突变(BRCAm)和更广泛的同源重组缺陷(HRD)群体,结果显示,与贝伐单抗单药治疗相比,Lynparza+贝伐单抗联合治疗显示更大的治疗受益。在BRCAm阳性亚组中,Lynparza+贝伐单抗联合治疗疾病进展或死亡风险降低69%(HR=0.31,中位PFS:37.2个月 vs 21.7个月)。在更广泛的HRD阳性亚组(约占新诊晚期卵巢癌女性患者病例的一半,包括BRCAm)中,Lynparza+贝伐单抗联合治疗将疾病进展或死亡风险降低了67%(HR=0.33,中位PFS:37.2个月 vs 17.7个月)。
Lynparza是一种首创、口服多聚ADP核糖聚合酶(PARP)抑制剂,可利用肿瘤DNA损伤修复(DDR)通路的缺陷优先杀死癌细胞,这种作用模式赋予了Lynparza治疗存在DNA损伤修复缺陷的广泛类型肿瘤的潜力。
Lynparza是全球上市的首个PARP抑制剂,于2014年12月首次获美国FDA批准。截至目前,该药已获全球60多个国家批准,用于维持治疗铂敏感复发性卵巢癌(不论BRCA状态如何)。该药在美国、欧盟、日本、中国等多个国家还被批准作为一线维持疗法,用于含铂化疗后病情缓解的BRCA突变(BRCAm)晚期卵巢癌。此外,在包括美国和日本在内40多个国家还被批准用于先前接受过化疗的生殖系BRCAm HER2阴性转移性乳腺癌,在欧盟,该适应症包括局部晚期乳腺癌。在美国,Lynparza还被批准用于生殖系BRCA突变的转移性胰腺癌的一线维持治疗。目前,Lynparza治疗卵巢癌、乳腺癌、胰腺癌正在接受其他管辖区域的监管审查。
阿斯利康与默沙东于2017年7月达成肿瘤学全球战略合作,共同开发和商业化Lynparza及另一种MEK抑制剂selumetinib治疗多种类型肿瘤。在PARP抑制剂范畴,Lynparza拥有最广泛和最先进的临床试验开发项目。目前,双方正在合作,调查Lynparza作为单药疗法以及组合疗法用于广泛类型肿瘤的治疗潜力。
在中国市场,Lynparza(利普卓)于2018年8月获批,用于铂敏感复发性卵巢癌的维持治疗。Lynparza是中国市场首个获批治疗卵巢癌的靶向药物,标志着中国卵巢癌治疗进入PARP抑制剂时代。
2019年12月初,Lynparza(利普卓)再次获批,用于BRCA突变晚期卵巢癌患者的一线维持治疗。受益于中国大力支持医药创新及加速推进临床急需新药审批,Lynparza(利普卓)成为中国首个获批用于卵巢癌一线维持疗法的PARP抑制剂。2019年11月28日,Lynparza(利普卓)被列入国家医保目录。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


