Science全文编译:全球!中国团队发布新冠疫苗动物实验研究结果
来源:本站原创 2020-05-09 08:26
2020年5月9日讯/生物谷BIOON/---世界卫生组织(WHO)于2020年1月30日宣布2019年冠状病毒病(COVID-19)疫情为国际关注的公共卫生紧急事件,并于2020年3月11日宣布为大流行。据报道,约80%的COVID-19患者有轻度至中度症状,约20%的患者出现严重的临床表现,如重症肺炎、急性呼吸窘迫综合征(ARDS)、败血症甚至死亡。CO
2020年5月9日讯/生物谷BIOON/---世界卫生组织(WHO)于2020年1月30日宣布2019年冠状病毒病(COVID-19)疫情为国际关注的公共卫生紧急事件,并于2020年3月11日宣布为大流行。据报道,约80%的COVID-19患者有轻度至中度症状,约20%的患者出现严重的临床表现,如重症肺炎、急性呼吸窘迫综合征(ARDS)、败血症甚至死亡。COVID-19病例在全球范围内以惊人的速度增长。
作为当前大流行的致病病毒,新型冠状病毒SARS-CoV-2属于冠状病毒科的β冠状病毒属。SARS-CoV-2与严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)共同构成了人类冠状病毒中最能威胁生命的三种。
SARS-CoV-2携带线性单股正义RNA基因组,编码4种结构蛋白[刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)]、16种非结构蛋白(nsp1~nsp16)和几种辅助蛋白,其中S蛋白是一种主要的保护性抗原,能引发强效的中和抗体。目前还没有针对这种新出现的SARS-CoV-2的特异性抗病毒药物或疫苗。因此,开发疫苗的紧迫性对于遏制大流行和预防新的病毒爆发至关重要。
目前正在开发多种类型的SARS-CoV-2疫苗,比如基于DNA的疫苗制剂、基于RNA的疫苗制剂、含有病毒表位的重组亚基、腺病毒载体和纯化的灭活病毒。纯化的灭活病毒传统上就被用于疫苗开发,这类疫苗在预防流感病毒和脊髓灰质炎病毒等病毒引起的疾病方面是安全有效的。
为了构建用于SARS-CoV-2候选疫苗开发的临床前体外中和模型和挑战模型,在一项新的研究中,来自中国医学科学院医学实验动物研究所、浙江省疾病预防控制中心、科兴控股生物技术有限公司、中国科学院生物物理研究所、中国食品药品检定研究院和中国疾病预防控制中心传染病预防控制所等研究机构的研究人员从11名住院患者(包括5名重症监护患者)---5名来自中国、3名来自意大利、1名来自瑞士、1名来自英国和1名来自西班牙---的支气管肺泡灌洗液(BALF)样本中分离出SARS-CoV-2毒株。这些患者在最近的疫情爆发期间感染了SARS-CoV-2。这11份样本含有的SARS-CoV-2毒株在利用所有可用序列构建的系统发育树上广泛分布,在一定程度上代表了传播的SARS-CoV-2毒株(图1A)。
相关研究结果于2020年5月6日在线发表在Science期刊上,论文标题为“Rapid development of an inactivated vaccine candidate for SARS-CoV-2”。论文通讯作者为中国医学科学院医学实验动物研究所所长秦川(Chuan Qin)、浙江省疾病预防控制中心微生物所所长张严峻(Yanjun Zhang)、科兴控股生物技术有限公司董事长兼首席执行官尹卫东(Weidong Yin)、中国科学院生物物理研究所重点实验室副主任王祥喜(Xiangxi Wang)、中国食品药品检定研究院呼吸道病毒疫苗室主任李长贵(Changgui Li)和中国疾病预防控制中心传染病预防控制所党委书记卢金星(Jinxing Lu)。
这些研究人员选择了SARS-CoV-2毒株CN2用于纯化的灭活SARS-CoV-2病毒疫苗(PiCoVacc)的开发,并选择了另外10种毒株(分别称为CN1、CN3~CN5和OS1~OS6)作为临床前挑战毒株。值得注意的是,CN1和OS1毒株分别与2019-nCoV-BetaCoV /Wuhan/WIV04/2019和EPI_ISL_412973密切相关,有报道称这两种毒株会引起严重的临床症状(包括呼吸衰竭),因而需要机械通气。
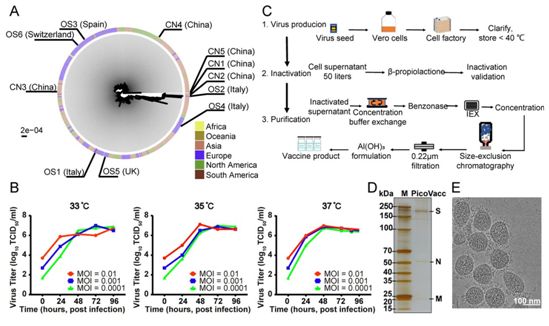
为了获得适应于在Vero细胞中高效生长的病毒原液(viral stock)以用于PiCoVacc开发,首先对CN2毒株进行病毒蚀斑纯化,并在Vero细胞中传代一次,产生P1病毒原液。此后,又进行了四次传代,产生P2~P5病毒原液。在Vero细胞中的P5病毒原液生长动力学分析表明这种病毒原液高效复制,并在33°C~37°C之间的温度下,在病毒感染复制数(MOI)为0.0001~0.01的情况下,在感染3或4天后达到6~7 log10 TCID50/ml的峰值滴度(图1B)。为了评估PiCoVacc的遗传稳定性,再进行5次传代,得到P10病毒原液,并对P10、P1、P3和P5病毒原液进行全基因组测序。与P1病毒原液相比,P5和P10病毒原液中仅发生了两个氨基酸置换:E蛋白氨基酸残基32位点上的Ala→Asp(E-A32D)和nsp10蛋白氨基酸残基49位点上的Thr→Ile(nsp10-T49I),这提示着用于PiCoVacc开发的CN2毒株具有良好的遗传稳定性,它的S蛋白没有发生可能改变中和抗体结合表位的突变。
为了生产中试规模的PiCoVacc用于动物研究,CN2毒株用Cell Factory系统在50升Vero细胞培养液中进行增殖,随后用β-丙醇内酯进行病毒灭活(图1C)。通过深度过滤和两个优化的色谱步骤纯化出灭活的CN2毒株,从而得到了高纯度的PiCoVacc(图1D)。此外,针对PiCoVacc的低温电子显微镜(cryo-EM)分析显示出完整的椭圆形颗粒,直径为90~150 nm,椭圆形颗粒缀有冠状刺突,代表着这种病毒的融合前状态(图1E)。
为了评估PiCoVacc的免疫原性,在第0天和第7天给不同组的BALB/c小鼠(n = 10)注射不同剂量的与明矾佐剂混合在一起的PiCoVacc(剂量为0、1.5、3或6μg,而在假疫苗接种组(sham group)中,使用不含PiCoVacc但含有明矾佐剂的生理盐水作为替代)。没有观察到炎症或其他不良反应。在初次疫苗接种1~6周后,用酶联免疫吸附测定(ELISA)评估S蛋白、受体结合域(RBD)和N蛋白特异性抗体反应。SARS-CoV-2 S蛋白和RBD特异性IgG抗体在接种PiCoVacc疫苗的小鼠的血清中快速产生,并且在第6周时分别达到819200(>200 μg/ml)和409600(>100 μg/ml)的滴度峰值。RBD特异性IgG占S蛋白诱导的抗体反应的一半,这表明RBD是主要的免疫原,这与康复后的COVID-19患者血液中的血清学特征密切匹配(图2,A和B)。令人惊讶的是,在接种疫苗的小鼠中,诱导的N蛋白特异性IgG含量比靶向S蛋白或RBD的IgG低大约30倍(图2A)。
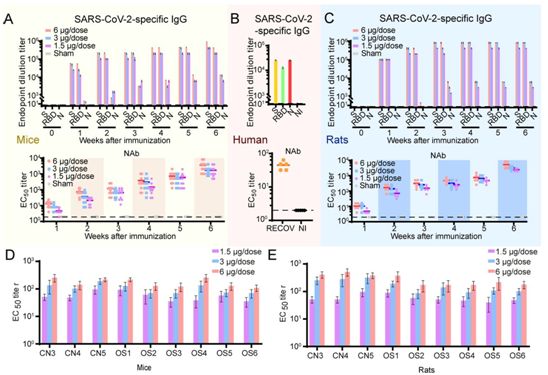
有趣的是,之前的研究已表明N蛋白特异性IgG在COVID-19患者的血清中含量丰富,可作为临床诊断标志物之一。值得注意的是,PiCoVacc可以在小鼠体内引起的S蛋白特异性抗体滴度比康复后的COVID-19患者血清中的S蛋白特异性抗体滴度高大约10倍(图2,A和B)。尽管这一观察结果目前还不能说明PiCoVacc在人体中产生类似结果的能力,但是它突显了PiCoVacc诱导强大免疫反应的潜力。由此可见,这些研究结果--再加上靶向SARS-CoV-2 N蛋白的抗体不能提供抵抗病毒感染的保护性免疫反应的这一事实---表明PiCoVacc可能能够诱发更有效的抗体反应(图2,A和B)。
接下来,这些研究人员使用微中和测定法(microneutralization assay, MN50)测定了一段时间内SARS-CoV-2特异性中和抗体。与S蛋白特异性IgG反应类似,针对CN1毒株的中和抗体滴度在第1周出现(高剂量疫苗接种时为12),在第2周进行加强疫苗接种后激增,而在第7周时,低/中剂量疫苗接种以及高剂量疫苗接种的中和抗体滴度分别达到1500和3000左右(图2A)。相比之下,假疫苗接种组没有产生可检测到的SARS-CoV-2特异性抗体反应(图2,A和B)。此外,在威斯塔大鼠中使用相同的免疫策略对PiCoVacc的免疫原性进行评估时获得类似的结果--在第7周时最大中和抗体滴度达到2048~4096(图2C)。为了研究PiCoVacc引发的中和反应,他们利用疫苗接种3周后收集的小鼠和大鼠血清对其他9种分离的SARS-CoV-2毒株进行了中和试验。对这些毒株的中和抗体滴度表明PiCoVacc能够诱发抗体,而且所诱发出的抗体可能对世界范围内传播的SARS-CoV-2毒株表现出有效的中和活性(图2,D和E)。
这些研究人员接下来评估了PiCoVacc在恒河猴中的免疫原性和保护效果,其中恒河猴是一种非人灵长类动物,在遭受SARS-CoV-2感染后可出现类似于COVID-19的疾病。在第0、7和14天通过肌肉注射途径给恒河猴(n=4)注射中剂量(剂量为3μg)或高剂量(剂量为6μg)的PiCoVacc疫苗。在这两个疫苗接种组中,S蛋白特异性IgG和中和抗体在第2周经诱导后产生,并在第3周(在病毒挑战之前)抗体滴度分别上升到约12800和约50,这些抗体滴度与来自康复后的COVID-19患者的血清相似(图3,A和B)。出乎意料的是,中剂量疫苗接种组中的中和抗体滴度(61)在第3周时比在高剂量疫苗接种组中观察到的中和抗体滴度(50)高出约20%,这可能是由于个体差异:中剂量疫苗接种组中的一只恒河猴体内诱导的抗体滴度比该组另外三只恒河猴高出大约10倍(图3B)。当剔除这个例外后,中剂量疫苗接种组的中和抗体滴度会下降到34,比高剂量疫苗接种组低大约40%。
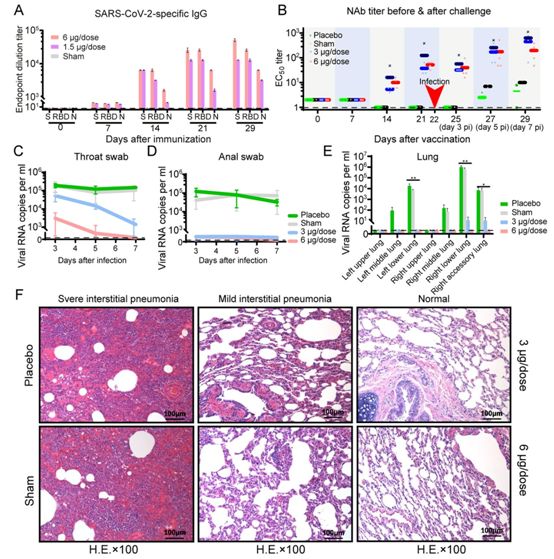
图3. PiCoVacc对非人灵长类动物的免疫原性及保护效果。
随后,这些研究人员进行了一项挑战研究,在第22天(第三次疫苗接种一周后),通过气管内途径将106 TCID50的SARS-CoV-2毒株CN1直接接种到接受过疫苗接种的恒河猴和作为对照的恒河猴的肺部中,以验证PiCoVacc的保护效果。果然,所有的对照组(假疫苗接种和安慰剂)恒河猴在接种CN1毒株第3~7天后,在咽部、肛周和肺部都出现过多的病毒基因组RNA拷贝数(104~106/ml),并出现严重的间质性肺炎(图3,C至F)。
相比之下,所有接种过PiCoVacc疫苗的恒河猴大体上都能抵御SARS-CoV-2感染,少数肺叶有非常轻微的局灶性组织病理学改变,这很可能是由于直接通过气管内途径将106 TCID50的CN1毒株接种到肺部后,肺部需要较长的时间(一周以上)才能完全恢复(图3F)。所有接种过PiCoVacc疫苗的恒河猴的病毒载量都明显下降,但是对照组恒河猴在感染后的第3~7天内的病毒载量略有增加(图3,C至E)。
所有4只接受高剂量疫苗接种的恒河猴在感染后第7天时,在咽部、肛周和肺部都没有检测到病毒载量。在中剂量疫苗接种组中,在感染后第7天时,确实从咽部(3/4)、肛周(2/4)和肺部(1/4)样本中部分检测到病毒载量短暂上升(viral blip),但与假疫苗接种组(sham group)相比,病毒载量减少了大约95%(图3,C至E)。
有趣的是,在疫苗接种组(中剂量免疫接种组和高剂量免疫接种组)的中和抗体滴度因中和病毒在感染后3天内下降了约30%,随后在感染后第5~7天迅速增加,以维持中和效果。与高剂量疫苗接种组(中和抗体滴度为大约145)相比,中剂量疫苗接种组在感染后第7天观察到的中和抗体滴度较高(4只恒河猴的中和抗体滴度为大约400),这可能是由于病毒复制水平相对较低,因此完全清除病毒可能需要较长的时间。尽管观察到中剂量疫苗接种组的恒河猴在感染前存在相对较低的中和抗体滴度,从而提供了部分保护,但是没有观察到抗体依赖性感染增强现象(antibody-dependent enhancement of infection, ADE)。在这项新的研究中,不能排除抗体滴度减弱后表现出ADE的可能性。为了解决这个问题,还需要开展进一步研究,在疫苗接种后较长时间内观察遭受病毒挑战的动物。
之前关于SARS和MERS候选疫苗开发的报道提出了出现肺部免疫病理变化的担忧,这可能是由2型辅助性T细胞(Th2)反应直接引起的,也可能是ADE的结果。尽管许多疫苗引发的T细胞反应已被证明是急性病毒清除的关键,但是防止随后的冠状病毒感染主要是通过体液免疫介导的。过度的T细胞反应所诱导的“细胞因子风暴(cytokine storm)”实际上已被证明能够加重COVID19发病。因此,任何SARS-CoV-2疫苗诱发的T细胞反应必须得到很好的控制,以避免免疫病理变化。
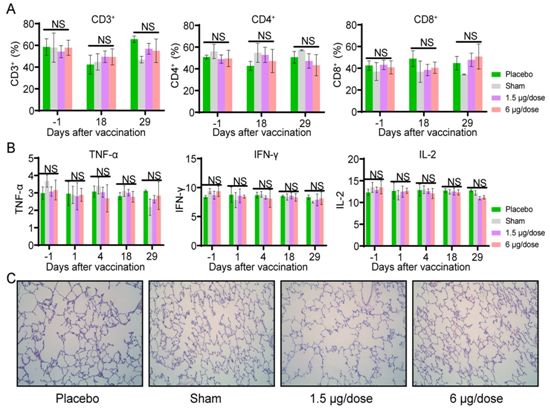
在此背景下,这些研究人员在这项新的研究中通过记录一些临床观察和生物学指标,系统地评估了PiCoVacc在恒河猴中的安全性。两组恒河猴(n=10)通过肌肉注射进行低剂量(1.5 μg)或高剂量(6 μg)PiCoVacc疫苗接种,另外两组恒河猴(n=10)在第0天、第7天和第14天用佐剂(假疫苗接种组)和生理盐水(安慰剂组)免疫3次。在接种PiCoVacc疫苗后,没有观察到任何恒河猴出现发热和体重下降,所有恒河猴的食欲和精神状态均保持正常。包括生化血液测试、淋巴细胞亚群百分比(CD3+、CD4+和CD8+)和关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)在内的血液和生化分析结果显示与假疫苗接种组和安慰剂组相比,疫苗接种组无明显变化(图4,A和B)。此外,在第29天时对这4组恒河猴的各种器官(包括肺部、心脏、脾脏、肝脏、肾脏和大脑)的组织病理学评估显示PiCoVacc疫苗在恒河猴中没有引起明显病变(图4C)。
目前COVID19的严重流行,以及全球死亡人数急剧增加,使得迫切需要开发一种SARS-CoV-2疫苗。在临床前研究和临床试验这两个阶段的疫苗开发中,安全性和有效性是至关重要的。虽然现在确定研究SARS-CoV-2感染的最佳动物模型还为时过早,但在SARS-CoV-2感染后出现COVID-19样症状的恒河猴似乎是研究这种疾病的有前景的动物模型。这些研究人员在这项新的研究中为PiCoVacc疫苗在恒河猴中的安全性提供了证据;并且在研究中没有观察到感染增强或免疫病理加重。这些数据还证明,在恒河猴中接种每剂量6μg的PiCoVacc疫苗对随后的SARS-CoV-2挑战有完全的保护作用。
总之,这些研究结果为SARS-CoV-2疫苗的临床开发提供了一条道路。PiCoVacc疫苗以及其他SARS-CoV-2候选疫苗的第I、II、III期临床试验预计将于今年晚些时候开始。(生物谷 Bioon.com)
参考文献:
Qiang Gao et al. Rapid development of an inactivated vaccine candidate for SARS-CoV-2. Science, 2020, doi:10.1126/science.abc1932.
作为当前大流行的致病病毒,新型冠状病毒SARS-CoV-2属于冠状病毒科的β冠状病毒属。SARS-CoV-2与严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)共同构成了人类冠状病毒中最能威胁生命的三种。
SARS-CoV-2携带线性单股正义RNA基因组,编码4种结构蛋白[刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)]、16种非结构蛋白(nsp1~nsp16)和几种辅助蛋白,其中S蛋白是一种主要的保护性抗原,能引发强效的中和抗体。目前还没有针对这种新出现的SARS-CoV-2的特异性抗病毒药物或疫苗。因此,开发疫苗的紧迫性对于遏制大流行和预防新的病毒爆发至关重要。
目前正在开发多种类型的SARS-CoV-2疫苗,比如基于DNA的疫苗制剂、基于RNA的疫苗制剂、含有病毒表位的重组亚基、腺病毒载体和纯化的灭活病毒。纯化的灭活病毒传统上就被用于疫苗开发,这类疫苗在预防流感病毒和脊髓灰质炎病毒等病毒引起的疾病方面是安全有效的。
为了构建用于SARS-CoV-2候选疫苗开发的临床前体外中和模型和挑战模型,在一项新的研究中,来自中国医学科学院医学实验动物研究所、浙江省疾病预防控制中心、科兴控股生物技术有限公司、中国科学院生物物理研究所、中国食品药品检定研究院和中国疾病预防控制中心传染病预防控制所等研究机构的研究人员从11名住院患者(包括5名重症监护患者)---5名来自中国、3名来自意大利、1名来自瑞士、1名来自英国和1名来自西班牙---的支气管肺泡灌洗液(BALF)样本中分离出SARS-CoV-2毒株。这些患者在最近的疫情爆发期间感染了SARS-CoV-2。这11份样本含有的SARS-CoV-2毒株在利用所有可用序列构建的系统发育树上广泛分布,在一定程度上代表了传播的SARS-CoV-2毒株(图1A)。
相关研究结果于2020年5月6日在线发表在Science期刊上,论文标题为“Rapid development of an inactivated vaccine candidate for SARS-CoV-2”。论文通讯作者为中国医学科学院医学实验动物研究所所长秦川(Chuan Qin)、浙江省疾病预防控制中心微生物所所长张严峻(Yanjun Zhang)、科兴控股生物技术有限公司董事长兼首席执行官尹卫东(Weidong Yin)、中国科学院生物物理研究所重点实验室副主任王祥喜(Xiangxi Wang)、中国食品药品检定研究院呼吸道病毒疫苗室主任李长贵(Changgui Li)和中国疾病预防控制中心传染病预防控制所党委书记卢金星(Jinxing Lu)。
这些研究人员选择了SARS-CoV-2毒株CN2用于纯化的灭活SARS-CoV-2病毒疫苗(PiCoVacc)的开发,并选择了另外10种毒株(分别称为CN1、CN3~CN5和OS1~OS6)作为临床前挑战毒株。值得注意的是,CN1和OS1毒株分别与2019-nCoV-BetaCoV /Wuhan/WIV04/2019和EPI_ISL_412973密切相关,有报道称这两种毒株会引起严重的临床症状(包括呼吸衰竭),因而需要机械通气。

图1. SARS-CoV-2候选疫苗PiCoVacc的特性分析。
为了获得适应于在Vero细胞中高效生长的病毒原液(viral stock)以用于PiCoVacc开发,首先对CN2毒株进行病毒蚀斑纯化,并在Vero细胞中传代一次,产生P1病毒原液。此后,又进行了四次传代,产生P2~P5病毒原液。在Vero细胞中的P5病毒原液生长动力学分析表明这种病毒原液高效复制,并在33°C~37°C之间的温度下,在病毒感染复制数(MOI)为0.0001~0.01的情况下,在感染3或4天后达到6~7 log10 TCID50/ml的峰值滴度(图1B)。为了评估PiCoVacc的遗传稳定性,再进行5次传代,得到P10病毒原液,并对P10、P1、P3和P5病毒原液进行全基因组测序。与P1病毒原液相比,P5和P10病毒原液中仅发生了两个氨基酸置换:E蛋白氨基酸残基32位点上的Ala→Asp(E-A32D)和nsp10蛋白氨基酸残基49位点上的Thr→Ile(nsp10-T49I),这提示着用于PiCoVacc开发的CN2毒株具有良好的遗传稳定性,它的S蛋白没有发生可能改变中和抗体结合表位的突变。
为了生产中试规模的PiCoVacc用于动物研究,CN2毒株用Cell Factory系统在50升Vero细胞培养液中进行增殖,随后用β-丙醇内酯进行病毒灭活(图1C)。通过深度过滤和两个优化的色谱步骤纯化出灭活的CN2毒株,从而得到了高纯度的PiCoVacc(图1D)。此外,针对PiCoVacc的低温电子显微镜(cryo-EM)分析显示出完整的椭圆形颗粒,直径为90~150 nm,椭圆形颗粒缀有冠状刺突,代表着这种病毒的融合前状态(图1E)。
为了评估PiCoVacc的免疫原性,在第0天和第7天给不同组的BALB/c小鼠(n = 10)注射不同剂量的与明矾佐剂混合在一起的PiCoVacc(剂量为0、1.5、3或6μg,而在假疫苗接种组(sham group)中,使用不含PiCoVacc但含有明矾佐剂的生理盐水作为替代)。没有观察到炎症或其他不良反应。在初次疫苗接种1~6周后,用酶联免疫吸附测定(ELISA)评估S蛋白、受体结合域(RBD)和N蛋白特异性抗体反应。SARS-CoV-2 S蛋白和RBD特异性IgG抗体在接种PiCoVacc疫苗的小鼠的血清中快速产生,并且在第6周时分别达到819200(>200 μg/ml)和409600(>100 μg/ml)的滴度峰值。RBD特异性IgG占S蛋白诱导的抗体反应的一半,这表明RBD是主要的免疫原,这与康复后的COVID-19患者血液中的血清学特征密切匹配(图2,A和B)。令人惊讶的是,在接种疫苗的小鼠中,诱导的N蛋白特异性IgG含量比靶向S蛋白或RBD的IgG低大约30倍(图2A)。

图2. PiCoVacc疫苗接种可引起对10种代表性的SARS-CoV-2分离株的中和抗体反应。
有趣的是,之前的研究已表明N蛋白特异性IgG在COVID-19患者的血清中含量丰富,可作为临床诊断标志物之一。值得注意的是,PiCoVacc可以在小鼠体内引起的S蛋白特异性抗体滴度比康复后的COVID-19患者血清中的S蛋白特异性抗体滴度高大约10倍(图2,A和B)。尽管这一观察结果目前还不能说明PiCoVacc在人体中产生类似结果的能力,但是它突显了PiCoVacc诱导强大免疫反应的潜力。由此可见,这些研究结果--再加上靶向SARS-CoV-2 N蛋白的抗体不能提供抵抗病毒感染的保护性免疫反应的这一事实---表明PiCoVacc可能能够诱发更有效的抗体反应(图2,A和B)。
接下来,这些研究人员使用微中和测定法(microneutralization assay, MN50)测定了一段时间内SARS-CoV-2特异性中和抗体。与S蛋白特异性IgG反应类似,针对CN1毒株的中和抗体滴度在第1周出现(高剂量疫苗接种时为12),在第2周进行加强疫苗接种后激增,而在第7周时,低/中剂量疫苗接种以及高剂量疫苗接种的中和抗体滴度分别达到1500和3000左右(图2A)。相比之下,假疫苗接种组没有产生可检测到的SARS-CoV-2特异性抗体反应(图2,A和B)。此外,在威斯塔大鼠中使用相同的免疫策略对PiCoVacc的免疫原性进行评估时获得类似的结果--在第7周时最大中和抗体滴度达到2048~4096(图2C)。为了研究PiCoVacc引发的中和反应,他们利用疫苗接种3周后收集的小鼠和大鼠血清对其他9种分离的SARS-CoV-2毒株进行了中和试验。对这些毒株的中和抗体滴度表明PiCoVacc能够诱发抗体,而且所诱发出的抗体可能对世界范围内传播的SARS-CoV-2毒株表现出有效的中和活性(图2,D和E)。
这些研究人员接下来评估了PiCoVacc在恒河猴中的免疫原性和保护效果,其中恒河猴是一种非人灵长类动物,在遭受SARS-CoV-2感染后可出现类似于COVID-19的疾病。在第0、7和14天通过肌肉注射途径给恒河猴(n=4)注射中剂量(剂量为3μg)或高剂量(剂量为6μg)的PiCoVacc疫苗。在这两个疫苗接种组中,S蛋白特异性IgG和中和抗体在第2周经诱导后产生,并在第3周(在病毒挑战之前)抗体滴度分别上升到约12800和约50,这些抗体滴度与来自康复后的COVID-19患者的血清相似(图3,A和B)。出乎意料的是,中剂量疫苗接种组中的中和抗体滴度(61)在第3周时比在高剂量疫苗接种组中观察到的中和抗体滴度(50)高出约20%,这可能是由于个体差异:中剂量疫苗接种组中的一只恒河猴体内诱导的抗体滴度比该组另外三只恒河猴高出大约10倍(图3B)。当剔除这个例外后,中剂量疫苗接种组的中和抗体滴度会下降到34,比高剂量疫苗接种组低大约40%。

图3. PiCoVacc对非人灵长类动物的免疫原性及保护效果。
随后,这些研究人员进行了一项挑战研究,在第22天(第三次疫苗接种一周后),通过气管内途径将106 TCID50的SARS-CoV-2毒株CN1直接接种到接受过疫苗接种的恒河猴和作为对照的恒河猴的肺部中,以验证PiCoVacc的保护效果。果然,所有的对照组(假疫苗接种和安慰剂)恒河猴在接种CN1毒株第3~7天后,在咽部、肛周和肺部都出现过多的病毒基因组RNA拷贝数(104~106/ml),并出现严重的间质性肺炎(图3,C至F)。
相比之下,所有接种过PiCoVacc疫苗的恒河猴大体上都能抵御SARS-CoV-2感染,少数肺叶有非常轻微的局灶性组织病理学改变,这很可能是由于直接通过气管内途径将106 TCID50的CN1毒株接种到肺部后,肺部需要较长的时间(一周以上)才能完全恢复(图3F)。所有接种过PiCoVacc疫苗的恒河猴的病毒载量都明显下降,但是对照组恒河猴在感染后的第3~7天内的病毒载量略有增加(图3,C至E)。
所有4只接受高剂量疫苗接种的恒河猴在感染后第7天时,在咽部、肛周和肺部都没有检测到病毒载量。在中剂量疫苗接种组中,在感染后第7天时,确实从咽部(3/4)、肛周(2/4)和肺部(1/4)样本中部分检测到病毒载量短暂上升(viral blip),但与假疫苗接种组(sham group)相比,病毒载量减少了大约95%(图3,C至E)。
有趣的是,在疫苗接种组(中剂量免疫接种组和高剂量免疫接种组)的中和抗体滴度因中和病毒在感染后3天内下降了约30%,随后在感染后第5~7天迅速增加,以维持中和效果。与高剂量疫苗接种组(中和抗体滴度为大约145)相比,中剂量疫苗接种组在感染后第7天观察到的中和抗体滴度较高(4只恒河猴的中和抗体滴度为大约400),这可能是由于病毒复制水平相对较低,因此完全清除病毒可能需要较长的时间。尽管观察到中剂量疫苗接种组的恒河猴在感染前存在相对较低的中和抗体滴度,从而提供了部分保护,但是没有观察到抗体依赖性感染增强现象(antibody-dependent enhancement of infection, ADE)。在这项新的研究中,不能排除抗体滴度减弱后表现出ADE的可能性。为了解决这个问题,还需要开展进一步研究,在疫苗接种后较长时间内观察遭受病毒挑战的动物。
之前关于SARS和MERS候选疫苗开发的报道提出了出现肺部免疫病理变化的担忧,这可能是由2型辅助性T细胞(Th2)反应直接引起的,也可能是ADE的结果。尽管许多疫苗引发的T细胞反应已被证明是急性病毒清除的关键,但是防止随后的冠状病毒感染主要是通过体液免疫介导的。过度的T细胞反应所诱导的“细胞因子风暴(cytokine storm)”实际上已被证明能够加重COVID19发病。因此,任何SARS-CoV-2疫苗诱发的T细胞反应必须得到很好的控制,以避免免疫病理变化。
在此背景下,这些研究人员在这项新的研究中通过记录一些临床观察和生物学指标,系统地评估了PiCoVacc在恒河猴中的安全性。两组恒河猴(n=10)通过肌肉注射进行低剂量(1.5 μg)或高剂量(6 μg)PiCoVacc疫苗接种,另外两组恒河猴(n=10)在第0天、第7天和第14天用佐剂(假疫苗接种组)和生理盐水(安慰剂组)免疫3次。在接种PiCoVacc疫苗后,没有观察到任何恒河猴出现发热和体重下降,所有恒河猴的食欲和精神状态均保持正常。包括生化血液测试、淋巴细胞亚群百分比(CD3+、CD4+和CD8+)和关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)在内的血液和生化分析结果显示与假疫苗接种组和安慰剂组相比,疫苗接种组无明显变化(图4,A和B)。此外,在第29天时对这4组恒河猴的各种器官(包括肺部、心脏、脾脏、肝脏、肾脏和大脑)的组织病理学评估显示PiCoVacc疫苗在恒河猴中没有引起明显病变(图4C)。

图4. PiCoVacc在非人灵长类动物中的安全性评价。
目前COVID19的严重流行,以及全球死亡人数急剧增加,使得迫切需要开发一种SARS-CoV-2疫苗。在临床前研究和临床试验这两个阶段的疫苗开发中,安全性和有效性是至关重要的。虽然现在确定研究SARS-CoV-2感染的最佳动物模型还为时过早,但在SARS-CoV-2感染后出现COVID-19样症状的恒河猴似乎是研究这种疾病的有前景的动物模型。这些研究人员在这项新的研究中为PiCoVacc疫苗在恒河猴中的安全性提供了证据;并且在研究中没有观察到感染增强或免疫病理加重。这些数据还证明,在恒河猴中接种每剂量6μg的PiCoVacc疫苗对随后的SARS-CoV-2挑战有完全的保护作用。
总之,这些研究结果为SARS-CoV-2疫苗的临床开发提供了一条道路。PiCoVacc疫苗以及其他SARS-CoV-2候选疫苗的第I、II、III期临床试验预计将于今年晚些时候开始。(生物谷 Bioon.com)
参考文献:
Qiang Gao et al. Rapid development of an inactivated vaccine candidate for SARS-CoV-2. Science, 2020, doi:10.1126/science.abc1932.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


