Nat Commun:揭示TRIM5α蛋白阻断HIV感染的分子机制
来源:本站原创 2020-05-11 17:19
2020年5月11日 讯 /生物谷BIOON/ --恒河猴机体中拥有一种特殊蛋白,当遭遇HIV感染时这种蛋白能帮其机体阻断病毒的入侵;近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自芝加哥大学的科学家们进行了一项创新性研究揭示了恒河猴体内这种名为TRIM5α的免疫蛋白是如何发挥作用的。图片来源:Alvin Yu研究者Alv
2020年5月11日 讯 /生物谷BIOON/ --恒河猴机体中拥有一种特殊蛋白,当遭遇HIV感染时这种蛋白能帮其机体阻断病毒的入侵;近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自芝加哥大学的科学家们进行了一项创新性研究揭示了恒河猴体内这种名为TRIM5α的免疫蛋白是如何发挥作用的。
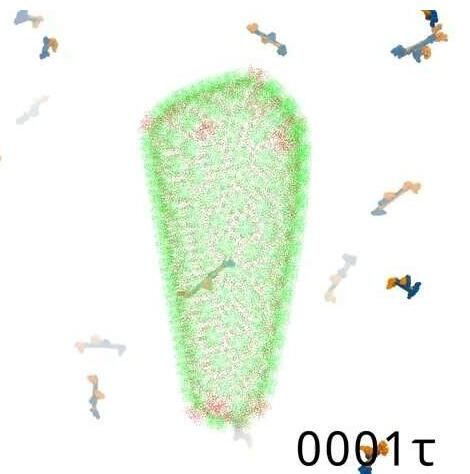
图片来源:Alvin Yu
研究者Alvin Yu表示,这些特殊的免疫蛋白能将HIV病毒衣壳包裹在一个六角形的网格中同时限制病毒的活性,这种网状结构的缺陷就能使得TRIM5α蛋白拥有包裹任何形状病毒入侵的灵活性。这项研究中,研究人员想通过研究利用计算机模拟的技术揭示该过程背后的物理性原理,但即使使用最大的超级计算机,模拟实际能代表HIV病毒中每一个原子也是比较困难的,因此在模拟中使用一种微妙的方法来挑选关键的部分似乎就是重要的,其也能被安全地像素化,这就是所谓的粗粒化(coarse graining)过程。
研究者Yu表示,TRIM5α蛋白能形成一种二维格子结构,但这种蛋白质如何机体缠绕在三维病毒衣壳上却是一个问题,因此研究人员就需要进行模拟研究来分析这些蛋白质是如何与入侵的病毒相互作用的。研究者所采用的新型模型能够揭示多个关键点,其中一种就是蛋白质能利用一种精细化的跳跃机制来逐渐在衣壳上积累直至其抵达临界点,随着网格结构的生长,蛋白质会以这样的方式挤压在一起从而使得网格结构中开始出现不规则的现象,研究者推测,这种不规则特性非常重要,因为恒河猴体内的TRIM5α蛋白能够不断适应不同形状的HIV“胶囊”,HIV的衣壳会在结构上不断变化,因此这些TRIM蛋白也需要拥有适应不同结构的能力。
阐明TRIM5α蛋白与病毒之间结合的分子机制也至关重要,蛋白质与病毒之间的相互作用存在一种微妙的平衡,这种网格结构的组装是一种集体行为,其只有在非常特殊的相互作用强度范围内才会发生;相关研究结果或能帮助指导HIV的治疗。
最后研究者Voth表示,本文研究结果对于计算机模拟也意义重大,这也是计算机模拟研究的一大进步,后期对于研究人员进行诸如HIV感染等多种人类疾病研究也非常重要。(生物谷Bioon.com)
原始出处:
Alvin Yu et al. TRIM5α self-assembly and compartmentalization of the HIV-1 viral capsid, Nature Communications (2020). DOI:10.1038/s41467-020-15106-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


