2020年4月Science期刊不得不看的亮点研究
- Ccr4-Not
- COVID-19
- MERS
- RNA依赖性RNA聚合酶
- SARS
- SARS-CoV-2
- SCAPE
- 主蛋白酶
- 代谢区室
- 嘌呤体
- 密码子
- 核糖体
- 灵长类动物
- 细胞分裂
- 细胞因子释放综合征
来源:本站原创 2020-04-29 20:30
2020年4月29日讯/生物谷BIOON/---2020年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.全文编译!荷兰科学家发表Science论文,在非人类灵长类动物模型中比较COVID-19、MERS和SARS的发病机制doi:10.1126/science.abb7314两份关于三名COVID-
2020年4月29日讯/生物谷BIOON/---2020年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.全文编译!荷兰科学家发表Science论文,在非人类灵长类动物模型中比较COVID-19、MERS和SARS的发病机制
doi:10.1126/science.abb7314
两份关于三名COVID-19患者肺组织学检查的报告显示双侧弥漫性肺泡损伤(DAD)、肺水肿和透明膜形成,这表明存在急性呼吸窘迫综合征(ARDS)以及肺泡腔内特征性的多核巨细胞,这类似于2002/2003年SARS-CoV疫情爆发期间的调查结果。先前曾在非人类灵长类动物模型(食蟹猴)中研究过SARS-CoV感染的发病机理,在这种动物模型中,年老动物更容易患病。
在一项新的研究中,来自荷兰多家研究机构的研究人员在食蟹猴中描述了SARS-CoV-2感染的特征,并与MERS-CoV感染和SARS-CoV的历史数据进行了比较。相关研究结果于2020年4月17日在线发表在Science期刊上,论文标题为“Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model”。
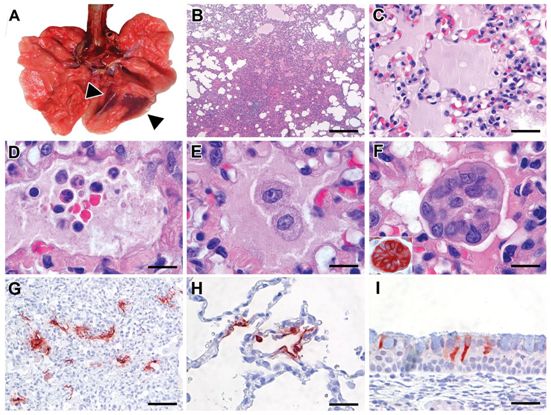
他们发现食蟹猴对SARS-CoV-2感染较为敏感,存在长时间脱落病毒,并表现出类似COVID-19的疾病。在这种非人类灵长类动物模型中,SARS-CoV-2在整个呼吸道组织(包括鼻腔、支气管、细支气管和肺泡)的呼吸道上皮细胞中有效地复制。上呼吸道中的病毒复制与宿主之间的有效传播相吻合,而下呼吸道中的病毒复制与肺部疾病的产生相吻合。对这种模型中SARS-CoV、MERS-CoV和SARS-CoV-2感染的深入比较,可能会发现这些新兴病毒的发病机制中的关键途径。这项新研究提供了一种新的感染模型,该模型对于评估和批准用于人类SARS-CoV-2感染的预防和治疗策略以及评估重新利用物种特异性现有疗法(比如聚乙二醇化干扰素)的疗效至关重要。
2.全文编译!Science期刊发文揭示重症COVID-19中的细胞因子释放综合征,并探讨潜在的治疗方法
doi:10.1126/science.abb8925
2019年12月,一种新型冠状病毒---SARS-CoV-2---横空出世。除了严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)之外,SARS-CoV-2是第三种引起人类严重呼吸道疾病---称为2019年冠状病毒病(COVID-19)---的冠状病毒。2020年3月,它被世界卫生组织(WHO)确认为大流行,对全球经济和健康产生了相当大的影响。尽管形势发展迅速,但在COVID-19病例中,有高达20%的COVID-19病例出现了以发热和肺炎为主要表现的严重疾病,从而导致急性呼吸窘迫综合征(ARDS)。这让人联想到在感染SARS-CoV和MERS-CoV的患者以及接受经过基因改造的T细胞治疗的白血病患者中观察到的细胞因子释放综合征(CRS)诱发的ARDS和继发性嗜血细胞增多症(sHLH)。鉴于这一经验,急需的基于抑制CRS的治疗药物(比如托珠单抗),已进入临床试验,用于治疗COVID-19。
SARS-CoV-2是一种与SARS-CoV关系最密切的β冠状病毒(betacoronavirus)。这两种病毒都是利用血管紧张素转换酶相关羧肽酶(ACE2)受体进入细胞。这种受体在心肺组织中广泛表达,但是在包括单核细胞和巨噬细胞在内的一些造血细胞中也有表达。SARS-CoV-2感染的一个重要特征是淋巴细胞减少(较低的血液淋巴细胞计数),这与临床严重程度有关。SARS-CoV能有效地感染原代人单核细胞和树突细胞,而MERS-CoV通过二肽基肽酶4(DPP4)感染单核细胞和T细胞。SARS-CoV-2也有可能感染树突细胞。由于树突细胞功能障碍,T细胞活化缺陷导致的T细胞凋亡和衰竭可能是COVID-19的免疫病理学的原因。然而,淋巴细胞减少作为COVID-19预后不良的生物标志物并不具有特异性,这是因为在2009年甲型H1N1流感大流行中,它也是与死亡相关的生物标志物。
鉴于全球缓解COVID-19大流行的紧迫性,有一些注意事项需要考虑。在败血症相关的ARDS中,通常会使用皮质类固醇激素。然而,在SARS和MERS患者中使用皮质类固醇并没有改善死亡率,并导致病毒清除延迟。因此,目前传染病权威机构和世界卫生组织的专家共识是避免对COVID-19患者进行全身性皮质类固醇治疗。一个理论上的可能性是利用IL-6拮抗抑制炎症可能会延缓病毒清除。然而,IL-6阻断也会导致血清IL-10(一种由巨噬细胞分泌的免疫抑制性细胞因子)的快速降低,这可能会减轻对延长病毒清除时间的担忧。此外,一到两剂IL-6拮抗剂不太可能导致并发症,如真菌感染或下颌骨坏死等,这些并发症在每月服用这类药物治疗类风湿性关节炎等慢性疾病的患者中发生。值得注意的是,托珠单抗首先被批准用于治疗风湿性疾病,随后又被批准用于治疗接受CAR-T细胞治疗的患者中出现的CRS,现在又被进一步转用于遏制COVID-19大流行。在未来涉及流感病毒和埃博拉病毒等其他病毒的大流行中也有可能使用IL-6靶向疗法。
3.Science:COVID-19或呈季节性复发,夏季高温也不会使之消亡!
doi:10.1126/science.abb5793
哈佛大学(Harvard)的研究人员对普通感冒进行了研究,以寻找有关COVID-19病毒可能如何表现的线索。这些研究结果由哈佛大学陈曾熙公共卫生学院(Harvard T.H. Chan School of Public Health)流行病学、免疫学和传染病学系的科学家撰写,并于近日发表在Science杂志上。由博士后Stephen Kissler和博士生Christine Tedijanto领导的研究人员使用了SARS-CoV-2的近亲来模拟它在未来几个月的行为。SARS-CoV-2是导致COVID-19的病毒。
HCoV-OC43和HCoV-HKU1病毒有规律地传播并引起普通感冒。研究人员利用它们建立了一个模型,该模型考察了潜在的季节性、社交疏远策略的影响以及病毒在未来致病中的作用。研究人员说,这些设想并没有考虑如果开发出疫苗或治疗方法会对结果产生怎样的影响--因为这两种方法似乎都不会马上出现。
在每一个模拟的场景中,他们发现温暖的天气并没有阻止传播。这是因为,以普通感冒为例,大部分人通常会在春天生病并产生免疫力。然而,有了SARS-CoV-2,足够多的人可能仍然易受感染,即使在温暖的月份里传播减少了,它也能传播。
关于这种新型冠状病毒的另一个未知因素是感染后免疫力能够维持的时间。像感冒这样的短期免疫力持续不到一年,在最初的大流行高峰过后,将导致每年的COVID-19暴发。另一方面,永久免疫将在病毒最初爆发后的5年或更长的时间内消除病毒的传播。
研究人员还研究了单次和多次社交疏远对保持病人人数的影响,以使医疗系统能够应对。Kissler说,最有效的干预措施是一系列的社交疏远期,再加上监测疾病复发的有效检测,以便在病例淹没整个系统之前重新制定措施。研究人员说,这样的情况不仅导致了最少的死亡,而且还使人群逐渐获得了对病毒的免疫力。
4.Science:单个细胞分裂错误导致一连串具有癌症特征的突变
doi:10.1126/science.aba0712; doi:10.1126/science.abb4899
染色体断裂-融合-桥循环(breakage-fusion-bridge cycle, BFB循环)是一种灾难性的突变过程,常见于肿瘤发生过程中,可导致基因扩增并推动基因组快速进化。BFB循环的主要机制尚不清楚,尤其是在这种循环中,染色体桥如何断裂的关键特征。此外,根据经典BFB 模型预测的简单DNA序列重排模式并不常见于癌症基因组中。相反,BFB循环的DNA序列特征往往伴随着其他的基因组重排,包括另一种灾难性的突变模式,即染色体碎裂(chromothripsis)。
在一项新的研究中,来自美国多家研究机构的研究人员在一种已定义的系统中重现了BFB循环的基本步骤,使得能够进行机理研究和确定染色体桥形成的直接和长期基因组后果。为了确定染色体桥断裂的直接后果,他们将活细胞成像与单细胞全基因组测序(Look-Seq)相 结合。通过比较子细胞或孙细胞(granddaughter cell, 即子细胞在分裂后产生的子细胞)的单倍型拷贝数和结构变异,就可以揭示BFB循环中的复杂突变机制,其中的一些突变机制经过两代以上才会发生。随后,在让实验诱导的4号染色体双着丝粒融合(dicentric fusion)形成的染色体桥发生断裂后,他们对源自单细胞的细胞群体进行了基因组分析,从而确定了染色体桥断裂的长期后果。相关研究结果发表在2020年4月17日的Science期刊上,论文标题为“Mechanisms generating cancer genome complexity from a single cell division error”。
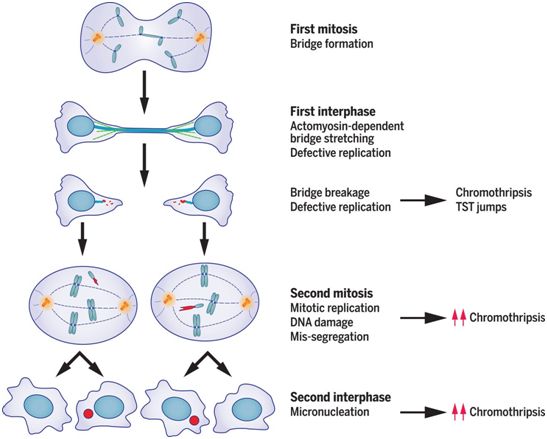
这些研究人员确定了一连串揭示单个细胞分裂错误---染色体桥形成---如何迅速产生癌症基因组的许多标志性特征的事件,包括持续的基因组进化和亚克隆异质性。这些结果促使人们对当前的染色体BFB模型进行了实质性的修正,并确立了染色体碎裂的发作将与BFB循环 内在地交织在一起。这些突变事件在癌症中很常见,但很可能也会在发育过程中和生物进化过程中发生。
5.Science:揭示Ccr4-Not复合物监测翻译中核糖体的密码子最优性
doi:10.1126/science.aay6912
在多种真核生物中,密码子最优性(codon optimality)已被确立为决定mRNA半衰期的关键参数。此外,人们已经确定了富含非最优密码子的短寿命mRNA的及时衰减需要Ccr4-Not复合物。Ccr4-Not是一种重要的蛋白复合物,它在mRNA降解中的作用已得到很好的研究。在 mRNA降解中,它作为主要的细胞质3′-poly(A)-尾巴去腺苷酶(deadenylase),启动了大多数mRNA的降解。Ccr4-Not复合物通过去腺苷化和随后激活RNA脱帽复合物,使得mRNA能够被主要的核酸外切酶(比如位于5′端的Xrn1和位于3′端的外切体)接触到。Ccr4-Not复 合物对密码子的优化监测并对mRNA衰减进行协调的分子机制至今仍不明确。
在一项新的研究中,来自德国慕尼黑大学、日本东北大学和美国凯斯西储大学的研究人员通过结合低温电镜(cryo-EM)、核糖体分析(ribosome profiling)和生物化学分析来深入了解在mRNA稳态的背景下Ccr4-Not复合物和翻译复合物之间的联系。相关研究结果发表在 2020年4月17日的Science期刊上,论文标题为“The Ccr4-Not complex monitors the translating ribosome for codon optimality”。
这项研究阐明了mRNA衰减介导的Ccr4-Not复合物与核糖体之间的直接物理联系。依赖于Not4亚基之前对eS7进行的泛素化,当因较慢的解码动力学使得核糖体A位点缺乏tRNA时,Ccr4-Not复合物(通过Not5亚基)特异性地结合到核糖体E位点。核糖体的这种状态是在它的A 位点中存在非最优密码子的情况下发生的,这就解释了富含非最优密码子的转录本半衰期较短的原因。因此,这些研究结果提供了关于Ccr4-Not复合物协调翻译效率与mRNA稳定性的机制上的新见解。
6.Science:首次发现存在参与嘌呤产生的功能性代谢区室
doi:10.1126/science.aaz6465; doi:10.1126/science.abb3094
40多年来,科学家们一直假设存在促进细胞内各种过程的酶簇(enzyme cluster)或“代谢区室(metabolon)”。在一项新的研究中,来自美国宾夕法尼亚州立大学的研究人员通过使用一种新的成像技术和质谱,首次直接观察到参与嘌呤(最为丰富的细胞代谢物)产生 的功能性代谢区室。这些发现可能会导致开发新的破坏癌症进展的治疗策略。相关研究结果发表在2020年4月17日的Science期刊上,论文标题为“Metabolomics and mass spectrometry imaging reveal channeled de novo purine synthesis in cells”。
这些研究人员寻找了一种特定类型的称为“嘌呤体(purinosome)”的代谢区室,嘌呤体被认为可以进行“从头进行嘌呤生物合成”,即合成新嘌呤的过程。他们研究了HeLa细胞(一种科学研究中常用的子宫颈癌细胞系)中的这些嘌呤体。
论文第一作者、宾夕法尼亚州立大学化学系助理研究教授Vidhi Pareek说,“我们证实从头进行嘌呤生物合成途径(de novo purine biosynthetic pathway, DNPB途径)是由至少9种协同作用的酶组成的嘌呤体执行的,这会将这些酶的总体活性提高了至少7倍。”
7.全文编译!我国科学家发表Science论文,揭示SARS-CoV-2病毒RNA依赖性RNA聚合酶的三维结构,助力开发新的疫苗和药物
doi:10.1126/science.abb7498
由新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)引起的2019年冠状病毒病(COVID-19)于2019年12月出现,此后成为全球大流行病。据报道,SARS-CoV-2是β冠状病毒(betacoronavirus)属的一个新成员,与严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和几种蝙蝠冠状病毒密切相关。与SARS-CoV和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)相比,SARS-CoV-2表现出更快的人际传播,从而导致世界卫生组织(WHO)宣布为世界性的公共卫生紧急事件。
冠状病毒使用一种多亚基复制/转录复合物。作为病毒多聚蛋白(polyprotein)ORF1a和ORF1ab的裂解产物而产生的一组非结构蛋白(nsp)组装在一起以促进病毒复制和转录。其中的一个关键组分---RNA依赖性RNA聚合酶(RdRp, 也称为nsp12)---催化病毒RNA合成,因而在SARS-CoV-2的复制和转录周期中起着至关重要的作用,它在这个过程中可能需要作为辅因子的nsp7和nsp8的协助。因此,nsp12被认为是瑞德西韦(remdesivir, 也称为GS-5734)等核苷酸类似物抗病毒抑制剂的主要靶点,其中瑞德西韦已显示出治疗SARS-CoV-2感染的潜力。
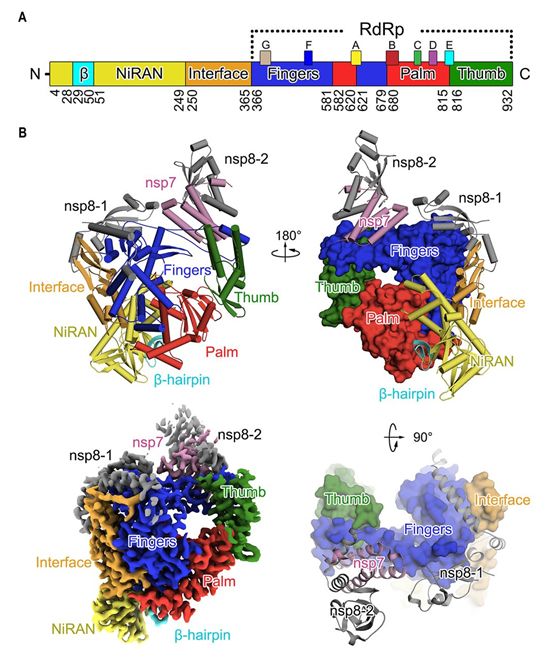
为了指导药物设计,在一项新的研究中,来自中国清华大学、上海科技大学、南开大学、天津大学和中国科学院生物物理研究所的研究人员使用了两种不同的方案:一种不存在DTT(数据集1),另一种存在DTT(数据集2),并利用低温电镜(cryo-EM)技术解析出nsp12与它的辅因子nsp7和nsp8形成复合物时的三维结构。相关研究结果于2020年4月10日在线发表在Science期刊上,论文标题为“Structure of the RNA-dependent RNA polymerase from COVID-19 virus”。
细菌表达的全长SARS-CoV-2 nsp12(残基S1-Q932)与nsp7(残基S1-Q83)和nsp8(残基A1-Q198)孵育在一起,然后纯化出所形成的复合物。在这种复合物的存在下制备出低温电镜网格,初步筛选后发现这种网格具有良好的分散性和极佳的颗粒密度。在收集和处理7994个显微影片后,这些研究人员在2.9埃的分辨率下实现对nsp12单体分别与nsp12-nsp8二聚体和 nsp8单体形成的复合物的三维重建,正如之前在SARS-CoV中观察到的那样。除了nsp12-nsp7-nsp8复合物,他们还观察到了对应于nsp12-nsp8二聚体以及单个nsp12单体的单颗粒类型,但这些都没有给出原子分辨率下的三维重建。然而,nsp12-nsp7-nsp8复合物的三维重建提供了完整的结构分析信息。
8.Science重大突破:我国科学家设计新药靶向SARS-CoV-2主蛋白酶!
doi:10.1126/science.abb4489
一个中国科学家团队最近开发了两种抑制SARS-CoV-2主要蛋白酶(Mpro)的新化合物,其中一种是进一步临床研究的良好候选药物。这项研究于4月22日在线发表在Science上,由中科院上海药物研究所柳红、许叶春、蒋华良院士团队、中科院武汉病毒研究所张磊砢/肖庚富团队和上海科技大学杨海涛/饶子和团队合作完成。
在分析了SARS-CoV-2 Mpro的底物结合位点后,科学家们设计并合成了两种化合物,11a和11b。研究人员随后使用基于荧光共振能量转移(FRET)的剪切实验测定了两种药物的IC50值。结果显示11a和11b都具有优异的SARS-CoV-2 Mpro抑制活性,其IC50值分别为0.053±0.005μM和0.040±0.002μM。
研究人员还使用了免疫荧光、实时荧光定量PCR和噬菌斑检测来监测11a和11b的抗病毒活性。结果表明,化合物11和11 b在细胞实验中表现出优异的抗SARS-CoV-2感染的能活性(例如噬菌斑实验检测出的EC50值分别为0.53±0.01μMμM和0.72±0.09,)。此外,这些化合物在体内表现出良好的药代动力学性能,表明它们是有希望的候选药物。然而,化合物11a的低毒性使它特别有希望。
为了阐明化合物11a和11b抑制SARS-CoV-2 Mpro的机制,科学家们以1.5埃的分辨率测定了配合物Mpro-11a (PDB: 6LZE)和Mpro-11b (PDB: 6M0K)的高分辨率晶体结构。这些配合物的高分辨率晶体结构不仅说明了SARS-CoV-2 Mpro可以与11a/11b相互作用,而且揭示了SARS-CoV-2的抑制机制。高分辨率的复合物分析有助于药物化学家设计新的抑制剂来对抗SARS-CoV-2。
本研究表明,基于结构的药物设计是设计针对SARS-CoV-2的特异性抗病毒先导药物的有效策略。化合物11a的临床前研究正在进行中。该团队决定与世界各地的科学家分享研究数据,以加速抗SARS-CoV-2药物的开发。
9.Science:新研究揭示可复制RNA的起源和复制机制
doi:10.1126/science.aay0688
虽然遗传信息通常编码在DNA中,并通过DNA模板复制的方式传递,但是RNA也可以作为遗传物质通过RNA模板复制的方式传递。人们已经描述了两类蛋白催化的RNA复制系统。在第一种RNA复制系统中,专门的RNA依赖性RNA聚合酶复制流感病毒和登革热病毒等RNA病毒的基因 组。在第二种RNA复制系统中,通常参与DNA转录成RNA的细胞酶可以复制某些RNA,比如植物类病毒(viroid)和人类丁型肝炎病毒(HDV)。利用DNA依赖性RNA聚合酶进行复制的RNA的多样性和潜在的分子机制尚未得到充分研究。先前已经描述了可以通过噬菌体T7 DNA依 赖性RNA聚合酶(T7 RNAP)在体外复制的五种RNA序列。这些可复制RNA(replicating RNA)的起源和T7 RNAP的复制要求尚不清楚。
在一项新的研究中,来自美国斯坦福大学的研究人员应用了下一代测序、微流控技术和生物信息学来解决(i)DNA依赖性RNA聚合酶如何复制RNA,(ii)哪些RNA模板可被有效地复制,(iii)可复制RNA的起源。相关研究结果发表在2020年4月10日的Science期刊上,论文 标题为“Transcription polymerase–catalyzed emergence of novel RNA replicons”。
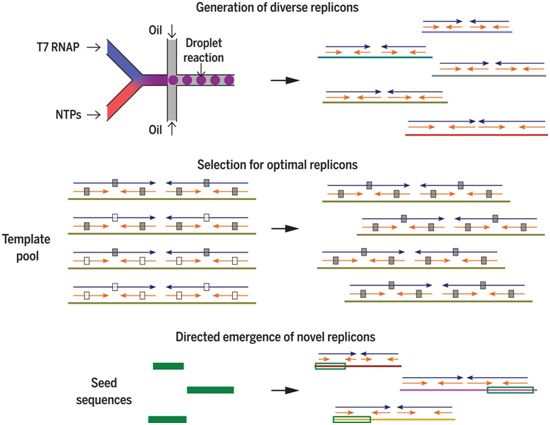
这些研究人员在没有明确添加模板的情形下建立了一系列T7 RNAP反应。这些反应产生具有不同序列的RNA复制子(RNA replicon),不过这些复制子具有由双向重复(在整个RNA长度上较长的反向重复)和四向重复(较短的反向重复嵌入在双向重复的每个臂中)确定的一 致性结构框架。
10.Science:人类“大脑计划”研究获重大突破!SCAPE技术有望在3D模式下观察分析人类大脑神经活性
doi:10.1126/science.aaz5390
近日,一项刊登在国际杂志Science上的研究报告中,来自美国国家神经性疾病和卒中研究中心等机构的科学家们通过研究开发了一种创新性的工具,其能帮助研究人员在3D模式下观察并分析大脑的神经活性。
由于受到现有工具的限制,如今科学家们仍然无法有效研究神经系统中的网络构架,并一次性观察大脑中大量的脑细胞;这项研究中,研究人员开发了一种名为SCAPE显微镜的超快速、3D成像技术,其能帮助研究人员对更大体积的组织进行观察,同时对活细胞中精细网络 的破坏性也小很多。
研究者Edmund Talley博士表示,这项研究中我们展示了如何利用“大脑计划”(BRAIN Initiative)技术的强大力量来帮助研究人类大脑如何解析信息来产生机体的感觉、思维和行动。SCAPE显微镜能帮助科学家们研究一次性需要实时观察的大体积组织样本,由于细胞 和组织能保持完好无损的状态并在三维空间内高速观察,因此后期研究人员还需要探索许多此前无法进行研究的新问题。(生物谷 Bioon.com)
1.全文编译!荷兰科学家发表Science论文,在非人类灵长类动物模型中比较COVID-19、MERS和SARS的发病机制
doi:10.1126/science.abb7314
两份关于三名COVID-19患者肺组织学检查的报告显示双侧弥漫性肺泡损伤(DAD)、肺水肿和透明膜形成,这表明存在急性呼吸窘迫综合征(ARDS)以及肺泡腔内特征性的多核巨细胞,这类似于2002/2003年SARS-CoV疫情爆发期间的调查结果。先前曾在非人类灵长类动物模型(食蟹猴)中研究过SARS-CoV感染的发病机理,在这种动物模型中,年老动物更容易患病。
在一项新的研究中,来自荷兰多家研究机构的研究人员在食蟹猴中描述了SARS-CoV-2感染的特征,并与MERS-CoV感染和SARS-CoV的历史数据进行了比较。相关研究结果于2020年4月17日在线发表在Science期刊上,论文标题为“Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model”。

接种SARS-CoV-2的食蟹猴肺部的特征性病理变化和病毒抗原表达。图片来自Science, 2020, doi:10.1126/science.abb7314。
他们发现食蟹猴对SARS-CoV-2感染较为敏感,存在长时间脱落病毒,并表现出类似COVID-19的疾病。在这种非人类灵长类动物模型中,SARS-CoV-2在整个呼吸道组织(包括鼻腔、支气管、细支气管和肺泡)的呼吸道上皮细胞中有效地复制。上呼吸道中的病毒复制与宿主之间的有效传播相吻合,而下呼吸道中的病毒复制与肺部疾病的产生相吻合。对这种模型中SARS-CoV、MERS-CoV和SARS-CoV-2感染的深入比较,可能会发现这些新兴病毒的发病机制中的关键途径。这项新研究提供了一种新的感染模型,该模型对于评估和批准用于人类SARS-CoV-2感染的预防和治疗策略以及评估重新利用物种特异性现有疗法(比如聚乙二醇化干扰素)的疗效至关重要。
2.全文编译!Science期刊发文揭示重症COVID-19中的细胞因子释放综合征,并探讨潜在的治疗方法
doi:10.1126/science.abb8925
2019年12月,一种新型冠状病毒---SARS-CoV-2---横空出世。除了严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)之外,SARS-CoV-2是第三种引起人类严重呼吸道疾病---称为2019年冠状病毒病(COVID-19)---的冠状病毒。2020年3月,它被世界卫生组织(WHO)确认为大流行,对全球经济和健康产生了相当大的影响。尽管形势发展迅速,但在COVID-19病例中,有高达20%的COVID-19病例出现了以发热和肺炎为主要表现的严重疾病,从而导致急性呼吸窘迫综合征(ARDS)。这让人联想到在感染SARS-CoV和MERS-CoV的患者以及接受经过基因改造的T细胞治疗的白血病患者中观察到的细胞因子释放综合征(CRS)诱发的ARDS和继发性嗜血细胞增多症(sHLH)。鉴于这一经验,急需的基于抑制CRS的治疗药物(比如托珠单抗),已进入临床试验,用于治疗COVID-19。
SARS-CoV-2是一种与SARS-CoV关系最密切的β冠状病毒(betacoronavirus)。这两种病毒都是利用血管紧张素转换酶相关羧肽酶(ACE2)受体进入细胞。这种受体在心肺组织中广泛表达,但是在包括单核细胞和巨噬细胞在内的一些造血细胞中也有表达。SARS-CoV-2感染的一个重要特征是淋巴细胞减少(较低的血液淋巴细胞计数),这与临床严重程度有关。SARS-CoV能有效地感染原代人单核细胞和树突细胞,而MERS-CoV通过二肽基肽酶4(DPP4)感染单核细胞和T细胞。SARS-CoV-2也有可能感染树突细胞。由于树突细胞功能障碍,T细胞活化缺陷导致的T细胞凋亡和衰竭可能是COVID-19的免疫病理学的原因。然而,淋巴细胞减少作为COVID-19预后不良的生物标志物并不具有特异性,这是因为在2009年甲型H1N1流感大流行中,它也是与死亡相关的生物标志物。
鉴于全球缓解COVID-19大流行的紧迫性,有一些注意事项需要考虑。在败血症相关的ARDS中,通常会使用皮质类固醇激素。然而,在SARS和MERS患者中使用皮质类固醇并没有改善死亡率,并导致病毒清除延迟。因此,目前传染病权威机构和世界卫生组织的专家共识是避免对COVID-19患者进行全身性皮质类固醇治疗。一个理论上的可能性是利用IL-6拮抗抑制炎症可能会延缓病毒清除。然而,IL-6阻断也会导致血清IL-10(一种由巨噬细胞分泌的免疫抑制性细胞因子)的快速降低,这可能会减轻对延长病毒清除时间的担忧。此外,一到两剂IL-6拮抗剂不太可能导致并发症,如真菌感染或下颌骨坏死等,这些并发症在每月服用这类药物治疗类风湿性关节炎等慢性疾病的患者中发生。值得注意的是,托珠单抗首先被批准用于治疗风湿性疾病,随后又被批准用于治疗接受CAR-T细胞治疗的患者中出现的CRS,现在又被进一步转用于遏制COVID-19大流行。在未来涉及流感病毒和埃博拉病毒等其他病毒的大流行中也有可能使用IL-6靶向疗法。
3.Science:COVID-19或呈季节性复发,夏季高温也不会使之消亡!
doi:10.1126/science.abb5793
哈佛大学(Harvard)的研究人员对普通感冒进行了研究,以寻找有关COVID-19病毒可能如何表现的线索。这些研究结果由哈佛大学陈曾熙公共卫生学院(Harvard T.H. Chan School of Public Health)流行病学、免疫学和传染病学系的科学家撰写,并于近日发表在Science杂志上。由博士后Stephen Kissler和博士生Christine Tedijanto领导的研究人员使用了SARS-CoV-2的近亲来模拟它在未来几个月的行为。SARS-CoV-2是导致COVID-19的病毒。
HCoV-OC43和HCoV-HKU1病毒有规律地传播并引起普通感冒。研究人员利用它们建立了一个模型,该模型考察了潜在的季节性、社交疏远策略的影响以及病毒在未来致病中的作用。研究人员说,这些设想并没有考虑如果开发出疫苗或治疗方法会对结果产生怎样的影响--因为这两种方法似乎都不会马上出现。
在每一个模拟的场景中,他们发现温暖的天气并没有阻止传播。这是因为,以普通感冒为例,大部分人通常会在春天生病并产生免疫力。然而,有了SARS-CoV-2,足够多的人可能仍然易受感染,即使在温暖的月份里传播减少了,它也能传播。
关于这种新型冠状病毒的另一个未知因素是感染后免疫力能够维持的时间。像感冒这样的短期免疫力持续不到一年,在最初的大流行高峰过后,将导致每年的COVID-19暴发。另一方面,永久免疫将在病毒最初爆发后的5年或更长的时间内消除病毒的传播。
研究人员还研究了单次和多次社交疏远对保持病人人数的影响,以使医疗系统能够应对。Kissler说,最有效的干预措施是一系列的社交疏远期,再加上监测疾病复发的有效检测,以便在病例淹没整个系统之前重新制定措施。研究人员说,这样的情况不仅导致了最少的死亡,而且还使人群逐渐获得了对病毒的免疫力。
4.Science:单个细胞分裂错误导致一连串具有癌症特征的突变
doi:10.1126/science.aba0712; doi:10.1126/science.abb4899
染色体断裂-融合-桥循环(breakage-fusion-bridge cycle, BFB循环)是一种灾难性的突变过程,常见于肿瘤发生过程中,可导致基因扩增并推动基因组快速进化。BFB循环的主要机制尚不清楚,尤其是在这种循环中,染色体桥如何断裂的关键特征。此外,根据经典BFB 模型预测的简单DNA序列重排模式并不常见于癌症基因组中。相反,BFB循环的DNA序列特征往往伴随着其他的基因组重排,包括另一种灾难性的突变模式,即染色体碎裂(chromothripsis)。
在一项新的研究中,来自美国多家研究机构的研究人员在一种已定义的系统中重现了BFB循环的基本步骤,使得能够进行机理研究和确定染色体桥形成的直接和长期基因组后果。为了确定染色体桥断裂的直接后果,他们将活细胞成像与单细胞全基因组测序(Look-Seq)相 结合。通过比较子细胞或孙细胞(granddaughter cell, 即子细胞在分裂后产生的子细胞)的单倍型拷贝数和结构变异,就可以揭示BFB循环中的复杂突变机制,其中的一些突变机制经过两代以上才会发生。随后,在让实验诱导的4号染色体双着丝粒融合(dicentric fusion)形成的染色体桥发生断裂后,他们对源自单细胞的细胞群体进行了基因组分析,从而确定了染色体桥断裂的长期后果。相关研究结果发表在2020年4月17日的Science期刊上,论文标题为“Mechanisms generating cancer genome complexity from a single cell division error”。

图片来自Science, 2020, doi:10.1126/science.aba0712。
这些研究人员确定了一连串揭示单个细胞分裂错误---染色体桥形成---如何迅速产生癌症基因组的许多标志性特征的事件,包括持续的基因组进化和亚克隆异质性。这些结果促使人们对当前的染色体BFB模型进行了实质性的修正,并确立了染色体碎裂的发作将与BFB循环 内在地交织在一起。这些突变事件在癌症中很常见,但很可能也会在发育过程中和生物进化过程中发生。
5.Science:揭示Ccr4-Not复合物监测翻译中核糖体的密码子最优性
doi:10.1126/science.aay6912
在多种真核生物中,密码子最优性(codon optimality)已被确立为决定mRNA半衰期的关键参数。此外,人们已经确定了富含非最优密码子的短寿命mRNA的及时衰减需要Ccr4-Not复合物。Ccr4-Not是一种重要的蛋白复合物,它在mRNA降解中的作用已得到很好的研究。在 mRNA降解中,它作为主要的细胞质3′-poly(A)-尾巴去腺苷酶(deadenylase),启动了大多数mRNA的降解。Ccr4-Not复合物通过去腺苷化和随后激活RNA脱帽复合物,使得mRNA能够被主要的核酸外切酶(比如位于5′端的Xrn1和位于3′端的外切体)接触到。Ccr4-Not复 合物对密码子的优化监测并对mRNA衰减进行协调的分子机制至今仍不明确。
在一项新的研究中,来自德国慕尼黑大学、日本东北大学和美国凯斯西储大学的研究人员通过结合低温电镜(cryo-EM)、核糖体分析(ribosome profiling)和生物化学分析来深入了解在mRNA稳态的背景下Ccr4-Not复合物和翻译复合物之间的联系。相关研究结果发表在 2020年4月17日的Science期刊上,论文标题为“The Ccr4-Not complex monitors the translating ribosome for codon optimality”。
这项研究阐明了mRNA衰减介导的Ccr4-Not复合物与核糖体之间的直接物理联系。依赖于Not4亚基之前对eS7进行的泛素化,当因较慢的解码动力学使得核糖体A位点缺乏tRNA时,Ccr4-Not复合物(通过Not5亚基)特异性地结合到核糖体E位点。核糖体的这种状态是在它的A 位点中存在非最优密码子的情况下发生的,这就解释了富含非最优密码子的转录本半衰期较短的原因。因此,这些研究结果提供了关于Ccr4-Not复合物协调翻译效率与mRNA稳定性的机制上的新见解。
6.Science:首次发现存在参与嘌呤产生的功能性代谢区室
doi:10.1126/science.aaz6465; doi:10.1126/science.abb3094
40多年来,科学家们一直假设存在促进细胞内各种过程的酶簇(enzyme cluster)或“代谢区室(metabolon)”。在一项新的研究中,来自美国宾夕法尼亚州立大学的研究人员通过使用一种新的成像技术和质谱,首次直接观察到参与嘌呤(最为丰富的细胞代谢物)产生 的功能性代谢区室。这些发现可能会导致开发新的破坏癌症进展的治疗策略。相关研究结果发表在2020年4月17日的Science期刊上,论文标题为“Metabolomics and mass spectrometry imaging reveal channeled de novo purine synthesis in cells”。
这些研究人员寻找了一种特定类型的称为“嘌呤体(purinosome)”的代谢区室,嘌呤体被认为可以进行“从头进行嘌呤生物合成”,即合成新嘌呤的过程。他们研究了HeLa细胞(一种科学研究中常用的子宫颈癌细胞系)中的这些嘌呤体。
论文第一作者、宾夕法尼亚州立大学化学系助理研究教授Vidhi Pareek说,“我们证实从头进行嘌呤生物合成途径(de novo purine biosynthetic pathway, DNPB途径)是由至少9种协同作用的酶组成的嘌呤体执行的,这会将这些酶的总体活性提高了至少7倍。”
7.全文编译!我国科学家发表Science论文,揭示SARS-CoV-2病毒RNA依赖性RNA聚合酶的三维结构,助力开发新的疫苗和药物
doi:10.1126/science.abb7498
由新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)引起的2019年冠状病毒病(COVID-19)于2019年12月出现,此后成为全球大流行病。据报道,SARS-CoV-2是β冠状病毒(betacoronavirus)属的一个新成员,与严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)和几种蝙蝠冠状病毒密切相关。与SARS-CoV和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)相比,SARS-CoV-2表现出更快的人际传播,从而导致世界卫生组织(WHO)宣布为世界性的公共卫生紧急事件。
冠状病毒使用一种多亚基复制/转录复合物。作为病毒多聚蛋白(polyprotein)ORF1a和ORF1ab的裂解产物而产生的一组非结构蛋白(nsp)组装在一起以促进病毒复制和转录。其中的一个关键组分---RNA依赖性RNA聚合酶(RdRp, 也称为nsp12)---催化病毒RNA合成,因而在SARS-CoV-2的复制和转录周期中起着至关重要的作用,它在这个过程中可能需要作为辅因子的nsp7和nsp8的协助。因此,nsp12被认为是瑞德西韦(remdesivir, 也称为GS-5734)等核苷酸类似物抗病毒抑制剂的主要靶点,其中瑞德西韦已显示出治疗SARS-CoV-2感染的潜力。

SARS-CoV-2病毒nsp12-nsp7-nsp8复合物的三维结构。图片来自Science, 2020, doi:10.1126/science.abb7498。
为了指导药物设计,在一项新的研究中,来自中国清华大学、上海科技大学、南开大学、天津大学和中国科学院生物物理研究所的研究人员使用了两种不同的方案:一种不存在DTT(数据集1),另一种存在DTT(数据集2),并利用低温电镜(cryo-EM)技术解析出nsp12与它的辅因子nsp7和nsp8形成复合物时的三维结构。相关研究结果于2020年4月10日在线发表在Science期刊上,论文标题为“Structure of the RNA-dependent RNA polymerase from COVID-19 virus”。
细菌表达的全长SARS-CoV-2 nsp12(残基S1-Q932)与nsp7(残基S1-Q83)和nsp8(残基A1-Q198)孵育在一起,然后纯化出所形成的复合物。在这种复合物的存在下制备出低温电镜网格,初步筛选后发现这种网格具有良好的分散性和极佳的颗粒密度。在收集和处理7994个显微影片后,这些研究人员在2.9埃的分辨率下实现对nsp12单体分别与nsp12-nsp8二聚体和 nsp8单体形成的复合物的三维重建,正如之前在SARS-CoV中观察到的那样。除了nsp12-nsp7-nsp8复合物,他们还观察到了对应于nsp12-nsp8二聚体以及单个nsp12单体的单颗粒类型,但这些都没有给出原子分辨率下的三维重建。然而,nsp12-nsp7-nsp8复合物的三维重建提供了完整的结构分析信息。
8.Science重大突破:我国科学家设计新药靶向SARS-CoV-2主蛋白酶!
doi:10.1126/science.abb4489
一个中国科学家团队最近开发了两种抑制SARS-CoV-2主要蛋白酶(Mpro)的新化合物,其中一种是进一步临床研究的良好候选药物。这项研究于4月22日在线发表在Science上,由中科院上海药物研究所柳红、许叶春、蒋华良院士团队、中科院武汉病毒研究所张磊砢/肖庚富团队和上海科技大学杨海涛/饶子和团队合作完成。
在分析了SARS-CoV-2 Mpro的底物结合位点后,科学家们设计并合成了两种化合物,11a和11b。研究人员随后使用基于荧光共振能量转移(FRET)的剪切实验测定了两种药物的IC50值。结果显示11a和11b都具有优异的SARS-CoV-2 Mpro抑制活性,其IC50值分别为0.053±0.005μM和0.040±0.002μM。
研究人员还使用了免疫荧光、实时荧光定量PCR和噬菌斑检测来监测11a和11b的抗病毒活性。结果表明,化合物11和11 b在细胞实验中表现出优异的抗SARS-CoV-2感染的能活性(例如噬菌斑实验检测出的EC50值分别为0.53±0.01μMμM和0.72±0.09,)。此外,这些化合物在体内表现出良好的药代动力学性能,表明它们是有希望的候选药物。然而,化合物11a的低毒性使它特别有希望。
为了阐明化合物11a和11b抑制SARS-CoV-2 Mpro的机制,科学家们以1.5埃的分辨率测定了配合物Mpro-11a (PDB: 6LZE)和Mpro-11b (PDB: 6M0K)的高分辨率晶体结构。这些配合物的高分辨率晶体结构不仅说明了SARS-CoV-2 Mpro可以与11a/11b相互作用,而且揭示了SARS-CoV-2的抑制机制。高分辨率的复合物分析有助于药物化学家设计新的抑制剂来对抗SARS-CoV-2。
本研究表明,基于结构的药物设计是设计针对SARS-CoV-2的特异性抗病毒先导药物的有效策略。化合物11a的临床前研究正在进行中。该团队决定与世界各地的科学家分享研究数据,以加速抗SARS-CoV-2药物的开发。
9.Science:新研究揭示可复制RNA的起源和复制机制
doi:10.1126/science.aay0688
虽然遗传信息通常编码在DNA中,并通过DNA模板复制的方式传递,但是RNA也可以作为遗传物质通过RNA模板复制的方式传递。人们已经描述了两类蛋白催化的RNA复制系统。在第一种RNA复制系统中,专门的RNA依赖性RNA聚合酶复制流感病毒和登革热病毒等RNA病毒的基因 组。在第二种RNA复制系统中,通常参与DNA转录成RNA的细胞酶可以复制某些RNA,比如植物类病毒(viroid)和人类丁型肝炎病毒(HDV)。利用DNA依赖性RNA聚合酶进行复制的RNA的多样性和潜在的分子机制尚未得到充分研究。先前已经描述了可以通过噬菌体T7 DNA依 赖性RNA聚合酶(T7 RNAP)在体外复制的五种RNA序列。这些可复制RNA(replicating RNA)的起源和T7 RNAP的复制要求尚不清楚。
在一项新的研究中,来自美国斯坦福大学的研究人员应用了下一代测序、微流控技术和生物信息学来解决(i)DNA依赖性RNA聚合酶如何复制RNA,(ii)哪些RNA模板可被有效地复制,(iii)可复制RNA的起源。相关研究结果发表在2020年4月10日的Science期刊上,论文 标题为“Transcription polymerase–catalyzed emergence of novel RNA replicons”。

图片来自Science, 2020, doi:10.1126/science.aay0688。
这些研究人员在没有明确添加模板的情形下建立了一系列T7 RNAP反应。这些反应产生具有不同序列的RNA复制子(RNA replicon),不过这些复制子具有由双向重复(在整个RNA长度上较长的反向重复)和四向重复(较短的反向重复嵌入在双向重复的每个臂中)确定的一 致性结构框架。
10.Science:人类“大脑计划”研究获重大突破!SCAPE技术有望在3D模式下观察分析人类大脑神经活性
doi:10.1126/science.aaz5390
近日,一项刊登在国际杂志Science上的研究报告中,来自美国国家神经性疾病和卒中研究中心等机构的科学家们通过研究开发了一种创新性的工具,其能帮助研究人员在3D模式下观察并分析大脑的神经活性。
由于受到现有工具的限制,如今科学家们仍然无法有效研究神经系统中的网络构架,并一次性观察大脑中大量的脑细胞;这项研究中,研究人员开发了一种名为SCAPE显微镜的超快速、3D成像技术,其能帮助研究人员对更大体积的组织进行观察,同时对活细胞中精细网络 的破坏性也小很多。
研究者Edmund Talley博士表示,这项研究中我们展示了如何利用“大脑计划”(BRAIN Initiative)技术的强大力量来帮助研究人类大脑如何解析信息来产生机体的感觉、思维和行动。SCAPE显微镜能帮助科学家们研究一次性需要实时观察的大体积组织样本,由于细胞 和组织能保持完好无损的状态并在三维空间内高速观察,因此后期研究人员还需要探索许多此前无法进行研究的新问题。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


